Алюминиевые сплавы
Наиболее распространенные элементы в составе алюминиевых сплавов — медь, марганец, магний, цинк и кремний. Реже встречаются сплавы с титаном, бериллием, цирконием и литием.
Алюминиевые сплавы условно разделяют на две группы: литейные и деформируемые.
Для изготовления литейных сплавов расплавленный алюминий заливают в литейную форму, которая соответствует конфигурации получаемого изделия. Эти сплавы часто содержат значительные примеси кремния для улучшения литейных свойств.
Деформируемые сплавы сначала разливают в слитки, а затем придают им нужную форму.
Происходит это несколькими способами в зависимости от вида продукта:
- Прокаткой, если необходимо получить листы и фольгу.
- Прессованием, если нужно получить профили, трубы и прутки.
- Формовкой, чтобы получить сложные формы полуфабрикатов.
- Ковкой, если требуется получить сложные формы с повышенными механическими свойствами.

История[править]

Статуя Антерос на площади Пиккадилли в Лондоне, изготовленная в 1893 и является одной из первых статуй, отлитых из алюминия
Название алюминий происходит от слова alumen (квасцы), которое в свою очередь произошло за Исидором (VII в. до н. э.), в связи с применением этого вещества в качестве протравы для краски: «Alumen vocatur a lumin e, quod lumen coloribus praestat tingendis».Плиний описывает квасцы и их соединения и находит память о них еще в трудах Геродота (V в. до н. э.) под названием σττπτηρία. Однако в то время квасцы не отличали от соединений с аналогичным действием, например железного купороса. В чистом виде квасцы были получены, очевидно, алхимиками. Земля, которая была в основе квасцов, то есть оксид алюминия, была впервые получена в 1754 году Маргграф, и позже получила название глинозем.
Хэмфри Дэви в 1808 году определил существование металла основы квасцов, и назвал его алюмиум, а позже алюминум. В течение 1808—1810 годов он пытался электролитически выделить этот металл из глинозема, однако это ему не удалось.
Впервые получить металлический алюминий удалось датскому физику Гансу Кристиану Эрстеду в 1825 году, термическим восстановлением безводного хлорида алюминия амальгамой калия.
Этот способ был усовершенствован Фридрихом Велером, который вместо амальгамы применил чистый калий в 1827 году. Веллеру также принадлежит первое примерно точное описание свойств металла.
В 1854 году Анри Сент-Клер Девиль усовершенствовал метод Веллера и наладил промышленное производство алюминия. Девиль в процессе получения алюминия заменил калий дешевым натрием, а также хлорид алюминия смесью AlCl3 с NaCl, за счет чего компоненты смеси находились в расплавленном состоянии. Опыты на заводе Жавеля завершились успешно и 18 июля 1855 года были получены первые слитки металла массой 6-8 кг, которые были показаны на Всемирной выставке в Париже. В то время алюминий был настолько дорогим, что на выставке он был выставлен рядом с сокровищами из государственной казны, а император Наполеон III использовал посуду из алюминия на государственных приемах.
В 1865 году русский ученый Николай Бекетов применил реакцию взаимодействия между криолитом и магнием для получения алюминия. Его способ мало чем отличался от способа Девилля, но был проще. В немецком городе Гмелингеми в 1885 году был построен завод, который работал по методу Бекетова, где за пять лет было получено 58 т алюминия — более 1/4 всего мирового производства алюминия в течение 1854—1890 годов.
Добыча алюминия химическим способом не могла обеспечить промышленность дешевым металлом, поэтому исследователям пришлось искать другие способы производства алюминия.
Еще в 1854 году Бунзену удалось получить алюминий электролитическим путем, а именно электролизом двойного хлорида натрия и алюминия.
В 1886 году Пауль Эру в Франции и Чарльз Гол в США почти одновременно, независимо друг от друга предложили добывать алюминий электролизом глинозема, расплавлением в криолите, чем начали современный способ получения алюминия. Мировое производство алюминия быстро росло и в 1893 году превысило 1 тыс. тонн в год.
В России первые 8 кг алюминия были получены 27 марта 1929 года в Ленинграде на заводе «Красный избиратель». В 1932 г. вступил в строй первый в СССР Волховский алюминиевый завод, а на следующий год — Днепровский в Запорожье (первый алюминиевый завод на Украине).
Кратко о процессе
 Плавка алюминия в домашних условиях — это не такой уж трудный процесс, которым он может показаться поначалу. Кусочки металла нагреваются до нужной температуры плавки алюминия в специальной емкости.
Плавка алюминия в домашних условиях — это не такой уж трудный процесс, которым он может показаться поначалу. Кусочки металла нагреваются до нужной температуры плавки алюминия в специальной емкости.
Некоторое время полученный расплав необходимо выдерживать в разогретом состоянии и периодически удалять с его поверхности образующийся шлак. После этого чистый жидкий металл наливается в специальную форму, в которой он некоторое время будет остывать.
Время, которое уйдет на плавку, зависит от самой печи, а точнее от той температуры, которую она может обеспечить. Если же вместо печи используется газовая горелка, то она должна нагревать металл сверху.
Основные характеристики алюминия

33 3превышает аналогичный показатель
Благодаря своему составу, этот металл можно легко раскатать в тонкий лист или вытянуть в проволоку. При соприкосновении с воздухом на его поверхности образуется оксидная пленка (оксид алюминия), которая является защитой от окисления и обеспечивает его высокие антикоррозионные свойства. Тонкий алюминий, например, фольга или порошок этого металла мгновенно сгорают, если их нагреть до высоких температур и становятся оксидом алюминия.
Металл не особенно устойчив к агрессивным кислотам. К примеру, его можно растворить в серной или соляной кислотах даже, если они разбавленны, особенно, если их нагреть. Однако он не растворяется ни в разбавленной ни в концентрированной и при этом холодной азотной кислоте, благодаря оксидной пленке. Определенное воздействие на металл имеют водные растворы щелочей — оксидный слой растворяется и образуются соли, содержащие этот металл в составе аниона — алюминаты.
Известно, что алюминий является самым часто встречающимся металлом в природе, но впервые в чистом виде его смог получить ученый-физик из Дании Х. Эрстед еще в 1925 году XIX века. Этот металл занимает третье место по распространенности в природе среди элементов и является лидером среди металлов. 8,8% алюминия содержит земная кора. Его выявили в составе слюд, полевых шпатов, глин и минералов.
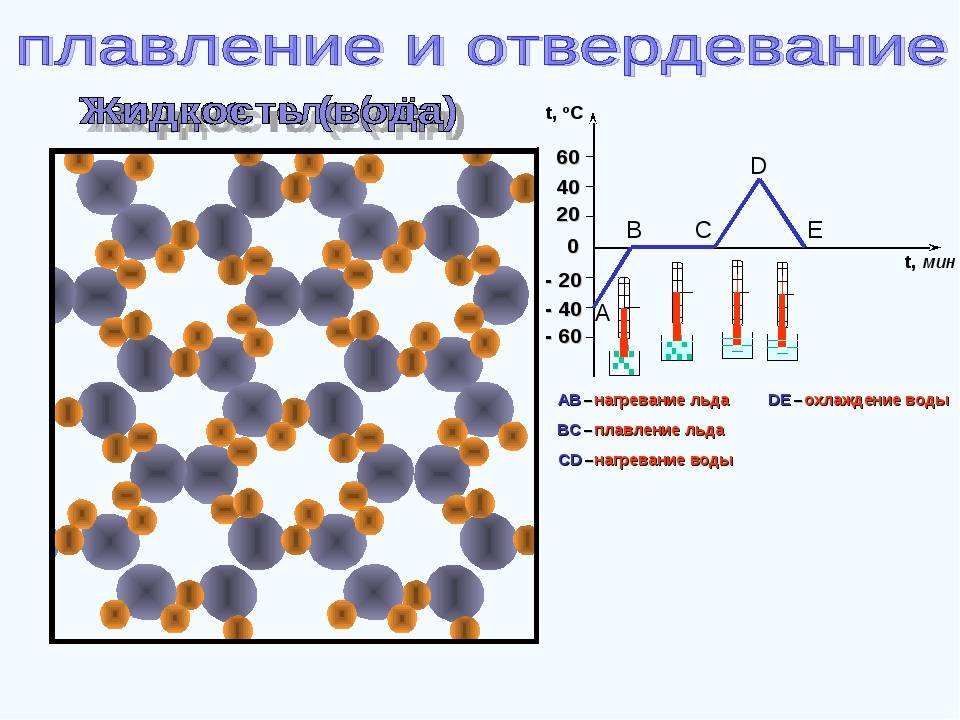
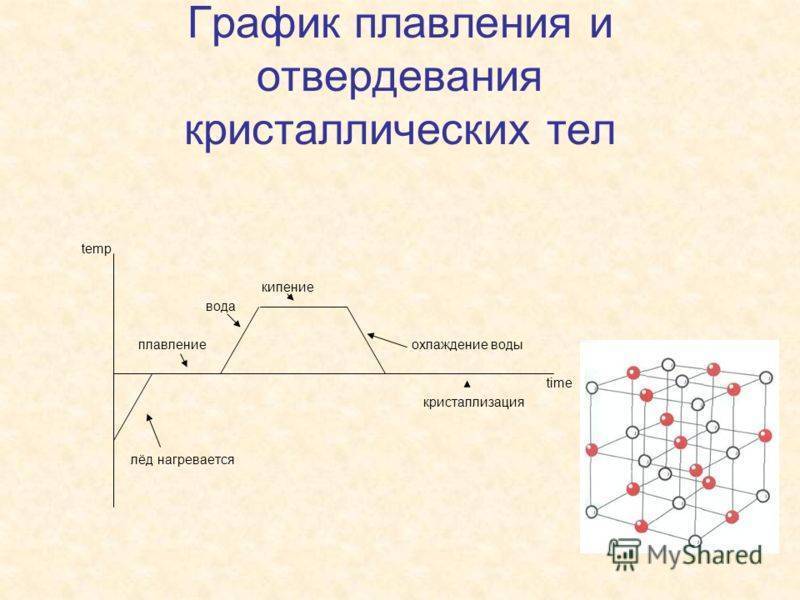
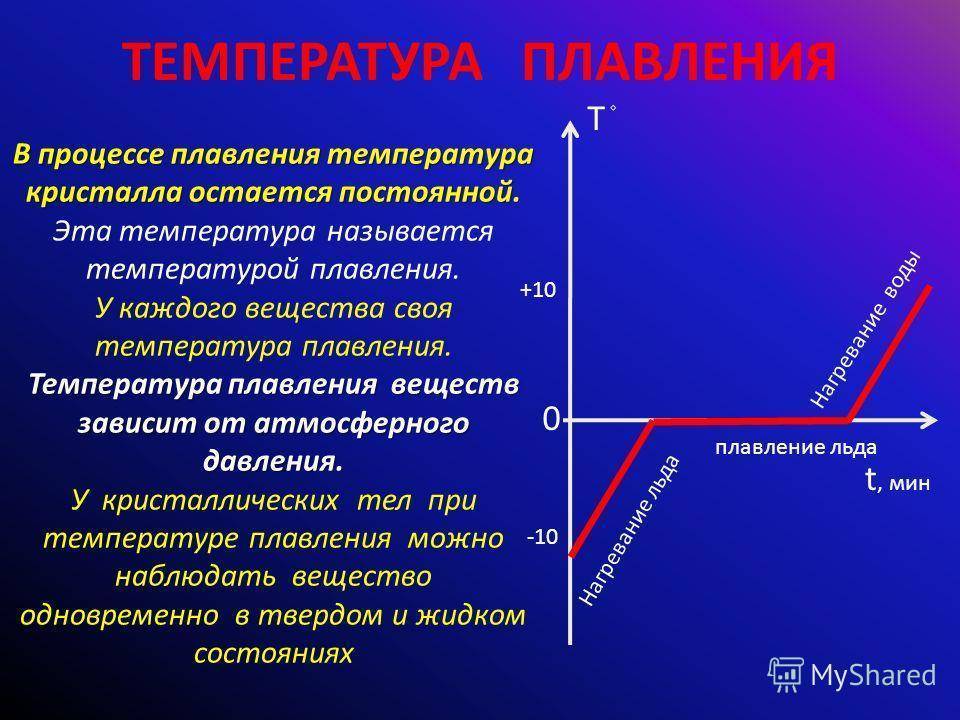
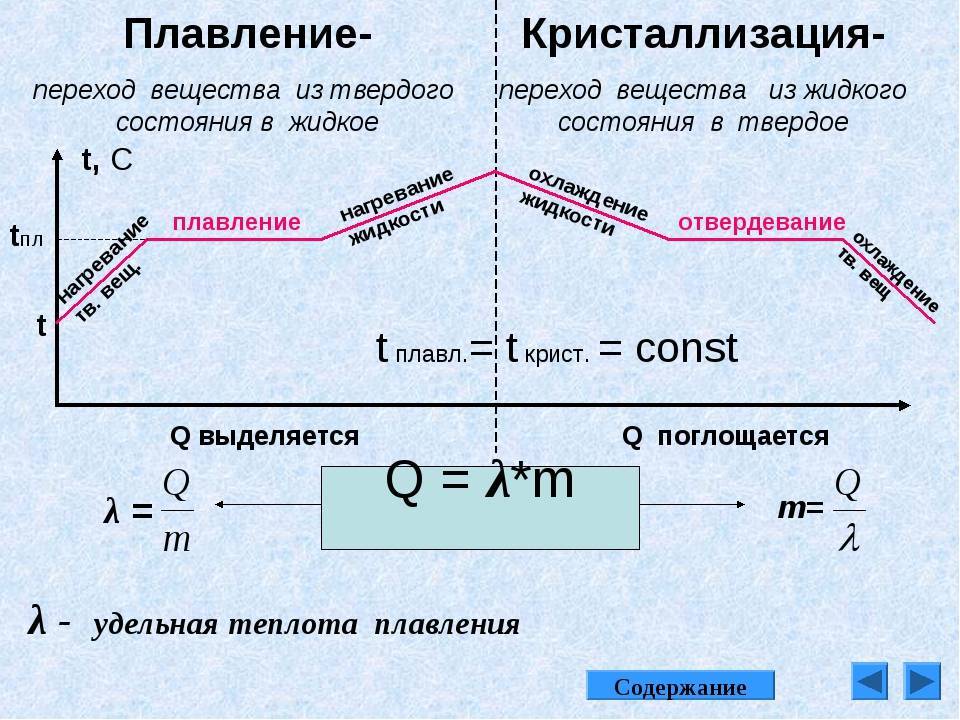
Что такое температура плавки металлов?

Итак, для расплавления металл нагревают извне до температуры плавки и продолжают нагревать для преодоления границы фазового перехода. Суть в том, что показатель температуры плавки означает температуру, при которой металл находится в фазовом равновесии, то есть между жидким и твердым телом. Другими словами существует одновременно, как в том, так и в другом состоянии. А для плавления нужно нагреть его больше пограничной температуры, чтобы процесс пошел в нужную сторону.
Стоит сказать о том, что только для чистых составов температура плавки постоянна. Если в составе металла находятся примеси, то это сместит границу фазового перехода, а, соответственно, и температура плавления будет другой. Это объясняется тем, что состав с примесями имеет иную кристаллическую структуру, в которой атомы взаимодейстуют между собой по-другому. Исходя из этого принципа, металлы можно разделить на:
- легкого плавления, такие как ртуть и галлий, например, (температура плавки до 600°С)
- среднеплавкие — это алюминий и медь (600-1600°С)
- тугоплавкие — молибден , вольфрам (больше 1600°С).
Знание показателя температуры плавления необходимо, как при производстве сплавов для правильного расчета их параметров, так и при эксплуатации изделий из них, поскольку этот показатель определяет ограничения их использования. Уже давным давно для удобства ученые физики свели эти данные в одну таблицу. Существуют таблицы температур плавки как металлов, так и их сплавов.
Температура плавления алюминия

температура плавления влияет на выбор
Указанная температура относится к процессу расплавки чистого алюминия. Так как в чистом виде он применяется реже, а введение в его состав примесей меняет температуру плавления. Сплавы алюминия изготавливаются для того, чтобы изменить какие-либо его свойства, увеличить прочность, например, или жароустойчивость. В качестве добавок применяют:
- цинк
- медь
- магний
- кремний
- марганец.
Обычно добавление других элементов в металл приводит к тому, что температура плавления сплава понижается, но не всегда. К примеру, добавление меди в объеме 5,7% приводит к понижению температуры плавления до 548ºС. Полученный сплав называют дюралюминием, его подвергают дальнейшей термической закалке. А алюминиево-магниевые составы плавятся при температуре 700 — 750ºС.
Во время процесса плавления необходим строгий контроль температуры расплава, а также присутствия газов в составе, которые выявляют через технологические пробы или способом вакуумной экстракции. На заключительной стадии производства сплавов алюминия проводят их модифицирование.
Вторичный алюминий
Источником для вторичного алюминия является алюминиевый лом и отходы алюминия во всех формах и видах изделий, а также шлаки и другие отходы алюминиевых литейных производств. Первичное и вторичное производство алюминия тесно связаны. Многие алюминиевые сплавы, деформируемые и литейные, предполагают наличие различных примесей, которые могут присутствовать во алюминиевом ломе и алюминиевых технологических отходах. В последние десятилетие применение алюминиевых отходов при производстве различной алюминиевой продукции неизменно возрастает. Примером этого является производство алюминиевого листа для производства банок для упаковки пива и прохладительных напитков.

Рисунок 6 – Алюминиевый лом: банки для упаковки пива и напитков
Подробно о алюминиевом ломе и вторичном алюминии:
Формальный заряд алюминиевой конструкции
Формальный заряд теоретический заряд, переносимый отдельным атомом в молекуле. Он играет важную роль в определении наиболее стабильной структуры Льюиса. Давайте сосредоточимся на этом.
Формальный заряд алюминия считается равным нулю, так как это единственный мономолекулярный атом металла, не имеющий связи с другими атомами. Формальный заряд рассчитывается по формуле = {Общее количество валентных электронов – количество несвязывающих электронов – (количество электронов, участвующих в образовании связи/2)}.
Алюминий не имеет несвязывающих электронов, а также связывающих электронов, поскольку он не образует ковалентной связи с каким-либо другим атомом. Следовательно, формальный заряд алюминия или любого другого мономолекулярного вещества будет равен нулю.
Физические свойства алюминия зависят от его чистоты
Таблица физических свойств алюминия | |
| Температура плавления Тпл, °С | 660 |
| Температура кипения Ткип, °С | 2 327 |
| Скрытая теплота плавления, Дж/г | 393,6 |
| Теплопроводность l , Вт/м град (при 20° С) | 228 |
| Теплоемкость Ср, Дж/(г · град) (при 0–100°С) | 0,88 |
| Коэффициент линейного расширения α × 10-6, 1/°С (пр°С) | 24,3 |
| Удельное электросопротивление ρ × 10-8, Ом× м (при 20°С) | 2,7 |
| Предел прочности σ в, МПа | 40–60 |
| Относительное удлинение δ , % | 40–50 |
| Твердость по Бринеллю НВ | 25 |
| Модуль нормальной упругости E , ГПа | 70 |
Плотность алюминия
Плотность твердого и расплавленного алюминия снижается по мере увеличения его чистоты: Плотность алюминия при 20°С
| Степень чистоты, % | 99,25 | 99,40 | 99,75 | 99.97 | 99,996 | 99.9998 |
| Плотность при 20°С, г/см3 | 2,727 | 2,706 | 2,703 | 2,6996 | 2,6989 | 2,69808 |
Плотность расплавленного алюминия при 1000°С
| Степень чистоты, % | 99,25 | 99.40 | 99.75 |
| Плотность, г/см3 | 2,311 | 2,291 | 2,289 |
Температура плавления и кипения.
В момент плавления алюминия возрастает объем металла: для алюминия чистотой 99,65 % — на 6,25%, для более чистого металла — на 6,60 %. По мере повышения степени чистоты алюминия температура его плавления возрастает: Зависимисть температуры плавления алюминия от чистоты
| Степень чистоты, % | 99,2 | 99,5 | 99,6 | 99,97 | 99,996 |
| Температура плавления, °С | 657 | 658 | 659,7 | 659,8 | 660,24 |
Теплопроводность алюминия
Теплопроводность алюминия повышается с увеличением степени его чистоты. Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Электропроводность алюминия
Алюминий отличается высокой электропроводностью (четвертое место среди металлов — после серебра, меди и золота). Удельная электропроводность алюминия чистотой 99,99 % при 20°С равна 37,9 мкСм×м, что составляет 63,7% от электропроводности меди . Более чистый алюминий обладает электропроводностью, равной 65,9% от электропроводности меди. На электропроводность алюминия влияет ряд факторов: степень деформации, режим термической обработки и т. д., решающую же роль играет природа примесей, присутствующих в алюминии. Примеси по их отрицательному влиянию на электропроводность алюминия можно расположить в следующий ряд: Cr, V, Mn, Ti, Mg, Ag, Сu, Zn, Si, Fe Ni. Наиболее отрицательное влияние на электросопротивление алюминия оказывают примеси Сг, V, Мп и Ti . Поэтому в алюминии для электротехнической промышленности сумма Cr+V+Mn+Ti не должна превышать 0,015% (марка А5Е) и даже 0,01 % (А7Е) при содержании кремния соответственно 0,12 и 0,16 %.
Влияние примесей на электропроводность алюминия
Основными примесями в алюминии являются кремний, железо, медь, цинк и титан. При малых содержаниях кремния в алюминии (0,06%) величина Fe : Si (в пределах от 0,8 до 3,8) сравнительно мало влияет на его электросопротивление. При увеличении содержания кремния до 0,15—0,16% влияние Fe : Si возрастает. Ниже приведено влияние Fe : Si на электропроводность алюминия: Влияние Fe : Si на электропроводность алюминия
| Fe : Si | 1,07 | 1,44 | 2,00 | 2,68 | 3,56 |
| Удельное электросопротивление алюминия, ×10-2 мкОм·мм: | |||||
| нагартованного | 2,812 | 2,816 | 2,822 | 2,829 | 2,838 |
| отожженного | 2,769 | 2,771 | 2,778 | 2,783 | 2,788 |
Удельное электрическое сопротивление отожженной алюминиевой проволоки (ρ, мкОм·м) при 20°С в зависимости от содержания примесей можно приблизительно определить по следующей формуле: ρ=0,0264+0,007×(% Si)+0,0007×(% Fe) + 0,04×.
Отражательная способность
С повышением степени чистоты алюминия возрастает его способность отражать свет от поверхности. Так, степень отражения белого света от прокатанных алюминиевых листов (фольги) в зависимости от чистоты металла, возрастает следующим образом: для Аl 99,2%—75%, Аl 99,5%—84% и для Аl 99,8%—86%. Поверхность листа, изготовленного из электролитически рафинированного алюминия чистотой 99,996%, отражает 90% падающего на него белого света.
www.metmk.com.ua
Виды и свойства алюминиевых сплавов
Алюминиево-магниевые сплавы
Эти пластичные сплавы обладают хорошей свариваемостью, коррозийной стойкостью и высоким уровнем усталостной прочности.
В алюминиево-магниевых сплавах содержится до 6% магния. Чем выше его содержание, тем прочнее сплав. Повышение концентрации магния на каждый процент увеличивает предел прочности примерно на 30 МПа, а предел текучести — примерно на 20 МПа. При подобных условиях уменьшается относительное удлинение, но незначительно, оставаясь в пределах 30–35%. Однако при содержании магния свыше 6% механическая структура сплава в нагартованном состоянии приобретает нестабильных характер, ухудшается коррозийная стойкость.
Для улучшения прочности в сплавы добавляют хром, марганец, титан, кремний или ванадий. Примеси меди и железа, напротив, негативно влияют на сплавы этого вида — снижают свариваемость и коррозионную стойкость.
Алюминиево-марганцевые сплавы
Это прочные и пластичные сплавы, которые обладают высоким уровнем коррозионной стойкости и хорошей свариваемостью.
Для получения мелкозернистой структуры сплавы этого вида легируют титаном, а для сохранения стабильности в нагартованном состоянии добавляют марганец. Основные примеси в сплавах вида Al-Mn — железо и кремний.
Сплавы алюминий-медь-кремний
Сплавы этого вида также называют алькусинами. Из-за высоких технических свойств их используют во втулочных подшипниках, а также при изготовлении блоков цилиндров. Обладают высокой твердостью поверхности, поэтому плохо прирабатываются.
Алюминиево-медные сплавы
Механические свойства сплавов этого вида в термоупрочненном состоянии порой превышают даже механические свойства некоторых низкоуглеродистых сталей. Их главный недостаток — невысокая коррозионная стойкость, потому эти сплавы обрабатывают поверхностными защитными покрытиями.
Алюминиево-медные сплавы легируют марганцем, кремнием, железом и магнием. Последний оказывает наибольшее влияние на свойства сплава: легирование магнием значительно повышает предел текучести и прочности. Добавление железа и никеля в сплав повышает его жаропрочность, кремния — способность к искусственному старению.
Алюминий-кремниевые сплавы
Сплавы этого вида иначе называют силуминами. Некоторые из них модифицируют добавками натрия или лития: наличие буквально 0,05% лития или 0,1% натрия увеличивает содержание кремния в эвтектическом сплаве с 12% до 14%. Сплавы применяются для декоративного литья, изготовления корпусов механизмов и элементов бытовых приборов, поскольку обладают хорошими литейными свойствами.
Сплавы алюминий-цинк-магний
Прочные и хорошо обрабатываемые. Типичный пример высокопрочного сплава этого вида — В95. Подобная прочность объясняется высокой растворимостью цинка и магния при температуре плавления до 70% и до 17,4% соответственно. При охлаждении растворимость элементов заметно снижается.
Основной недостаток этих сплавов — низкую коррозионную стойкость во время механического напряжения — исправляет легирование медью.
Авиаль
Авиаль — группа сплавов системы алюминий-магний-кремний с незначительными добавлениями иных элементов (Mn, Cr, Cu). Название образовано от сокращения словосочетания «авиационный алюминий».
Применять авиаль стали после открытия Д. Хансоном и М. Гейлером эффекта искусственного состаривания и термического упрочнения этой группы сплавов за счет выделения Mg2Si.
Эти сплавы отличаются высокой пластичностью и удовлетворительной коррозионной стойкостью. Из авиаля изготавливают кованые и штампованные детали сложной формы. Например, лонжероны лопастей винтов вертолетов. Для повышения коррозионной стойкости содержание меди иногда снижают до 0,1%.
Также сплав активно используют для замены нержавеющей стали в корпусах мобильных телефонов.
Оксид алюминия Al2O3
Оксид алюминия Al2O3, называемый также глиноземом, встречается в природе в кристаллическом виде, образуя минерал корунд. Корунд обладает очень высокой твердостью. Его прозрачные кристаллы, окрашенные в красный или синий цвет, представляют собой драгоценные камни — рубин и сапфир. В настоящее время рубины получают искусственно, сплавляя с глиноземом в электрической печи. Они используются не столько для украшений, сколько для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2O3, применяют а качестве квантовых генераторов — лазеров, создающих направленный пучек монохроматического излучения.
Корунд и его мелкозернистая разновидность, содержащая большое количество примесей — наждак, применяются как абразивные материалы.
Способы получения
Оксид алюминия можно получить различными методами:
1. Горением алюминия на воздухе:
4Al + 3O2 → 2Al2O3
2. Разложением гидроксида алюминия при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
3. Оксид алюминия можно получить разложением нитрата алюминия:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Химические свойства
Оксид алюминия — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например, оксид алюминия взаимодействует с оксидом натрия:
Na2O + Al2O3 → 2NaAlO2
2.Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Например, оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
2NaOH + Al2O3 → 2NaAlO2 + H2O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al2O3 + 2NaOH + 3H2O → 2Na
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например, оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al2O3 + 3SO3 → Al2(SO4)3
5.Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например, оксид алюминия реагирует с серной кислотой:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
6. Оксид алюминия проявляет слабые окислительные свойства.
Например, оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Al2O3 + 3CaH2 → 3CaO + 2Al + 3H2
Электрический токвосстанавливает алюминий из оксида (производство алюминия):
2Al2O3 → 4Al + 3O2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Физика и химия вещества
Из школьного курса химии известно, то алюминий – металл серебристо-белого цвета, обладающий низкой плотностью, высокой тепло- и электропроводностью. На воздухе покрывается защитной пленкой, которая легко растворяется в горячих растворах щелочей и кислот, некоторые его соединения обладают амфотерными свойствами. Даже на основе таких поверхностных сведений можно предложить несколько способов, как отличить алюминий от других металлов.
Главное отличие от нержавейки, железа, олова, свинца и других металлов, наиболее часто сдаваемых в металлолом, – низкая плотность, определить которую можно и в домашних условиях. Для этого понадобится мерный цилиндр и кухонные весы с точностью взвешивания до 1 грамма. Методика проста и не требует специальных знаний: предварительно взвешенную деталь из исследуемого материала опускаем в мерный цилинр, заполненный водой, и отмечаем изменение положения мениска жидкости. Далее делим массу детали на ее объем, равный разности уровня воды в цилиндре, и получаем плотность. Если получилось значение, близкое к 2,7 г/мл, то с высокой долей вероятности деталь сделана из алюминия.
В классической химии качественной реакцией на алюминий является проба с соляной кислотой и гидроксидом аммония. Если растворить алюминиевый образец в 10%-ом растворе соляной кислоты, а затем добавить обычный нашатырный спирт, то выпадет осадок Al(OH)3↓.
Внимание: реакция сопровождается бурным газообразованием (выделение водорода), поэтому необходимо соблюдать технику безопасности (защитные очки, перчатки, фартук). Простейший способ, как отличить алюминий от железа – магнитная проба: алюминиевые детали не будут притягиваться к магниту. Однако, этот эффект является необходимым, но не достаточным подтверждением того, что исследуемый образец изготовлен из алюминия, поскольку парамагнитными свойствами обладают как алюминиевые сплавы, так и некоторые цветные металлы
Далее показан опыт с магнитом на маятнике и листом алюминия (в случае отсутствия магнетизма маятник бы не остановился по-середине и, по энерции, продолжил колебаться)
Однако, этот эффект является необходимым, но не достаточным подтверждением того, что исследуемый образец изготовлен из алюминия, поскольку парамагнитными свойствами обладают как алюминиевые сплавы, так и некоторые цветные металлы. Далее показан опыт с магнитом на маятнике и листом алюминия (в случае отсутствия магнетизма маятник бы не остановился по-середине и, по энерции, продолжил колебаться)
Простейший способ, как отличить алюминий от железа – магнитная проба: алюминиевые детали не будут притягиваться к магниту. Однако, этот эффект является необходимым, но не достаточным подтверждением того, что исследуемый образец изготовлен из алюминия, поскольку парамагнитными свойствами обладают как алюминиевые сплавы, так и некоторые цветные металлы. Далее показан опыт с магнитом на маятнике и листом алюминия (в случае отсутствия магнетизма маятник бы не остановился по-середине и, по энерции, продолжил колебаться).