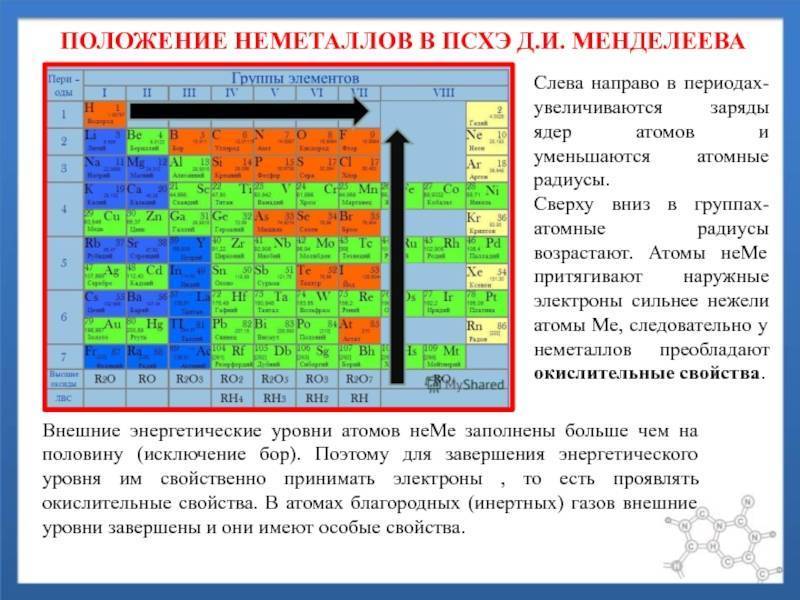
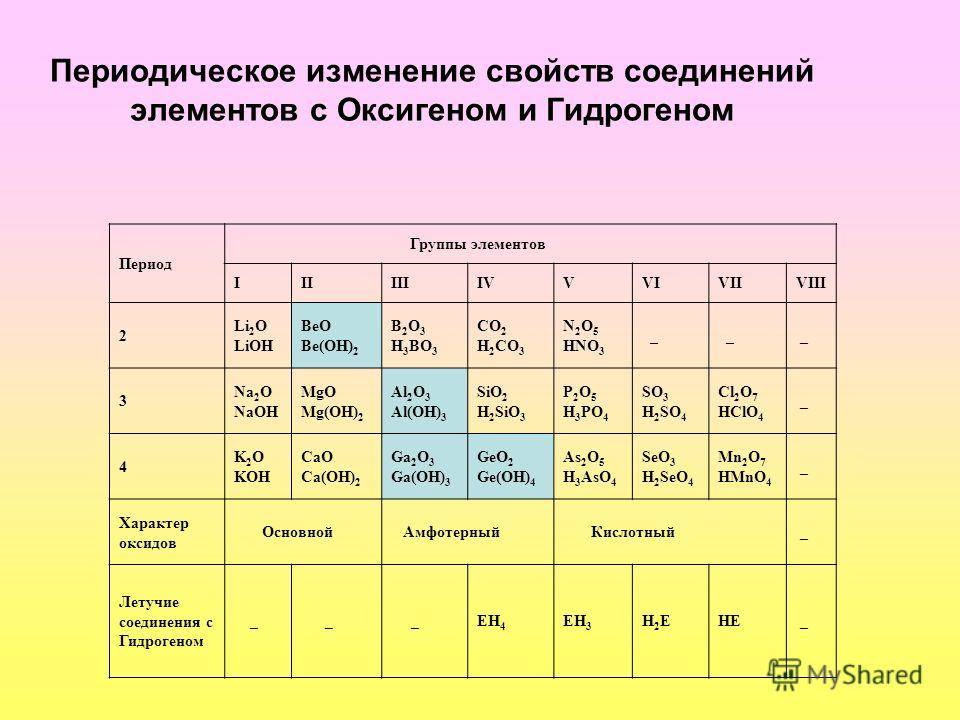
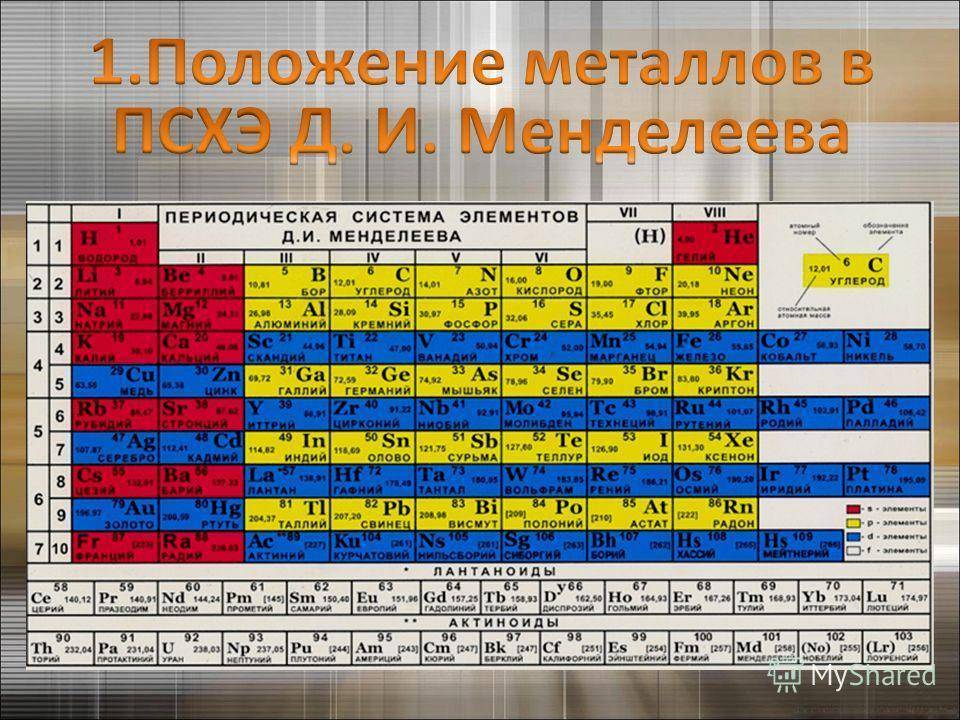
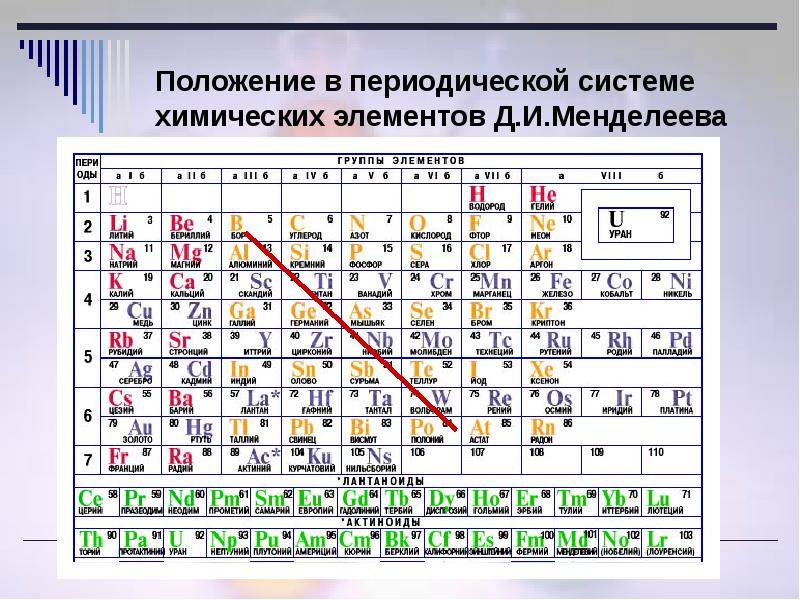
Распространение в природе
Оксиды актиноидов и лантаноидов часто называют циркониевой, ториевой, иттриевой землями. Они являются основным источником для получения соответствующих металлов. Уран, как главный представитель актиноидов, находится в наружном слое литосферы в форме четырёх видов руд или минералов. Прежде всего, это урановая смолка, представляющая собой двуокись урана. В ней содержание металла самое высокое. Часто диоксиду урана сопутствуют радиевые месторождения (жилы). Они встречаются в Канаде, Франции, Заире. Комплексы ториевой и урановой руды часто содержат руды других ценных металлов, например золота или серебра.

Запасами такого сырья богаты Россия, Южно-Африканская республика, Канада и Австралия. В некоторых осадочных породах содержится минерал карнотит. В его состав, кроме урана, входит еще и ванадий. Четвертый вид уранового сырья – это фосфатные руды и железоурановые сланцы. Их запасы находятся в Марокко, Швеции и США. В настоящее время перспективными считаются также залежи лигнитов и каменного угля, содержащие примеси урана. Их добывают в Испании, Чехии, а также в двух американских штатах – Северной и Южной Дакоте.
– Источник
Сокращение лантаноидов
→ Основная статья : Сокращение лантаноидов
Из-за сжатия лантаноидов атомный радиус почти непрерывно уменьшается в диапазоне от церия (183 мкм) до лютеция (172 мкм) (исключение составляют европий и иттербий). Это связано с тем, что элементы, которые – в зависимости от атомного номера – находятся перед лантаноидами, уже заполнили электронами оболочки 6s и 5p, но не оболочку 4f. Теперь лантаноиды заполняют 4f-оболочку электронами. В упрощенном представлении атома как состоящего из пространственно разделенных электронных оболочек, электронная оболочка, пространственно более близкая к ядру, теперь заполнена носителями заряда. Вдобавок ядро, конечно, заполнено тем же числом протонов, что и электроны, добавленные к 4f-оболочке. В результате более сильное притяжение между электронами и протонами сокращает атомный радиус, в то время как атомный номер увеличивается.
Этот эффект на самом деле не является исключительным, поскольку радиус всегда уменьшается, когда чаша наполняется в течение определенного периода времени. Однако это свойство имеет некоторые последствия:
- Благодаря уменьшающимся размерам легко возможно разделение с помощью ионообменников .
- В гольмии радиус Ln 3+ настолько мал, что почти соответствует радиусу Y 3+ ; поэтому иттрий обычно встречается вместе с «тяжелыми землями».
- Внутри группы переходные элементы во 2-й и 3-й позициях имеют очень похожие свойства.
Физические свойства
Температура плавления лантаноидов в целом увеличивается от лантана ( 920 ° C ) до лютеция ( 1652 ° C ). Считается, что в зависимости от степени гибридизации между орбитальным 6s, 4f и 5d. Эта гибридизация будет максимальной на уровне церия, который с электронной конфигурацией 6s 2 4f 1 5d 1 имеет самую низкую температуру плавления в семействе ( 795 ° C ).
Металлические свойства
Европия, с электронной конфигурацией 6s 2 4f 7 характеризуется подслоем 4f наполовину, отличаются своей плотностью значительно ниже ( 5,264 г · см -3 ), чем все другие лантаноиды, и его выше металлического радиусом ( 208,4 мкм ), чем у всех других лантаноидов. Его можно сравнить с барием, у которого радиус металла 222 мкм . Считается, что металлический европий образуется из ионов Eu 2+ , каждый из которых отправляет только два электрона через зону проводимости . Иттербия, с электронной конфигурацией 6s 2 4f 14 характеризуется подслоем 4f насыщенными, также имеет большой радиус проволоку, а сам по себе также формируется в металлическом состоянии, катионы Yb 2+ отправка каждых два электрона в зона проводимости.
Сопротивление металлических лантаноидов является относительно высокой, в пределах от 29 до 134 мкОм · см ; для сравнения, хороший электрический проводник, такой как алюминий, имеет удельное сопротивление 2,655 мкОм · см .
Магнитные и спектроскопические свойства
Лантаноиды парамагнитны, за исключением лантана, иттербия и лютеция, у которых нет ни одного электрона. Это приводит к высокой магнитной восприимчивости для этих элементов. Гадолиния является ферромагнитным ниже 16 ° C ( точки Кюри ), в то время как более тяжелые лантаноиды ( тербия, диспрозия, гольмия, эрбия, тулия и иттербия ) становятся ферромагнитного друг на гораздо более низкой температуре.
За исключением лантана и лютеция, все трехвалентные катионы Ln 3+ имеют неспаренных электронов в подслоя 4f. Однако их магнитный момент значительно отличается от их значения, полученного только из спина, из-за сильной спин-орбитальной связи . Максимальное число одиночных электронов достигается с Б – жьей 3+ иона, чей магнитный момент равен 7,94 МБ в то время как высокие магнитные моменты ( 10.4-10.7 М.Б. ) наблюдаются для ионов. Dy 3+ и Ho 3+
Однако все электроны Gd 3+ имеют параллельный спин, что важно при использовании гадолиния в качестве контрастного вещества при магнитно-резонансной томографии
Высвобождение вырождения 4f-орбиталей в ионах лантаноидов довольно мало, с более узким распределением уровней энергии, чем спин-орбитальное взаимодействие. Переходы между 4f орбиталями запрещены правилом Ляпорта (in) . Кроме того, поскольку эти орбитали относительно внутри атома, они слабо связаны с колебаниями молекул. Поэтому спектр ионов лантаноидов довольно слабый, и их полосы поглощения также узкие. Стекла, содержащие оксид гольмия (III) Ho 2 O 3и растворы оксида гольмия (III) (обычно в хлорной кислоте HClO 4) Демонстрируют интенсивные пики поглощения в спектральном диапазоне от 200 до 900 нм : они являются коммерчески доступными и могут быть использованы для калибровки из спектроскопов и монохроматоров .
Поскольку переходы f → f запрещены, релаксация возбужденного электрона в основное состояние происходит довольно медленно. Это делает лантаноиды интересными для создания лазеров, потому что в этом случае инверсия населенностей легко достижима. Nd: YAG – лазер, или иттрий-алюминиевый гранат Y 3 Al 5 O 12( YAG ), легированный неодимом, является очень распространенным типом лазеров. Иттрия ванадат YVO 4легированный европием был одним из первых фосфоресцирующих веществ, использованных для изготовления цветных электронно-лучевых трубок . Замечательные люминесцентные свойства лантаноидов обусловлены их 4f-орбиталями.
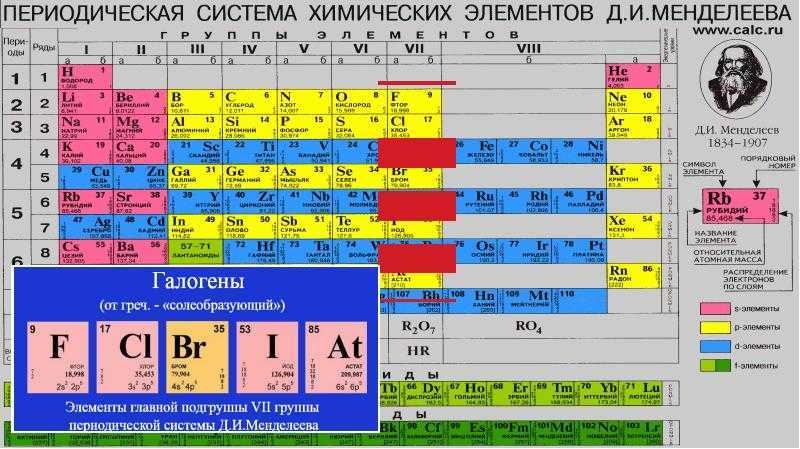
§ 10. Периодический закон в свете теории строения атома
*Положение в периодической системе d- и f-элементов
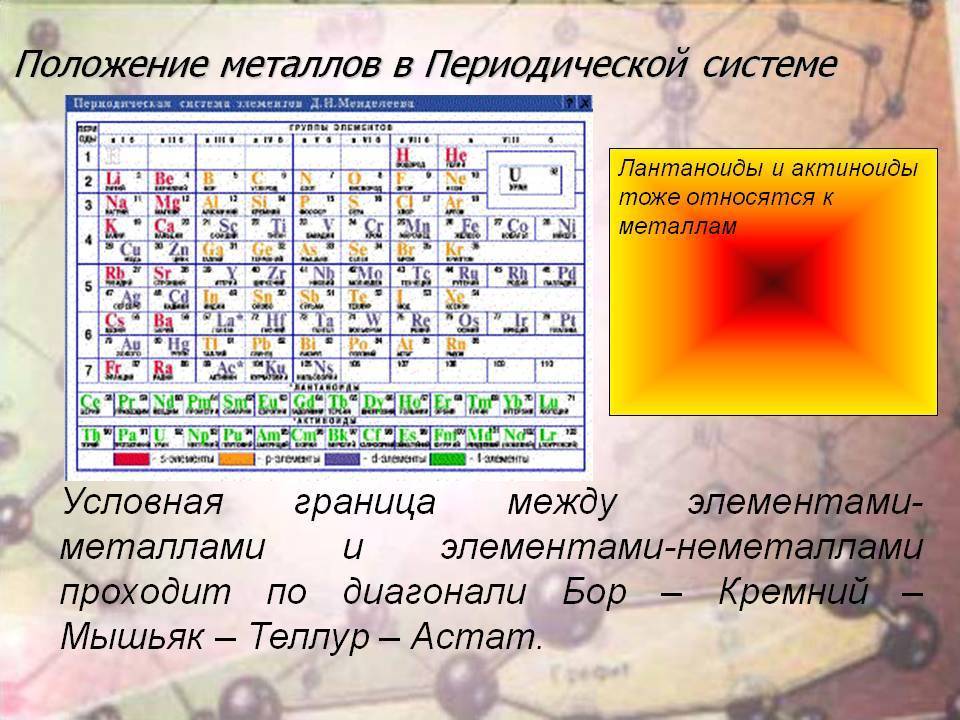
d– и f-Элементы относят к элементам B-групп. Так как эти элементы расположены в периодической системе между s– и p-элементами в 4–8-м периодах, их называют переходными.
В 4-м периоде (K — Kr) содержится 18 элементов. Ввиду большего числа элементов в этом периоде по сравнению с первыми тремя периодами Д. И. Менделеев назвал 4-й и последующие периоды большими.
Пятый период (Rb — Xe) построен аналогично 4-му: в нём также находится десять переходных d-элементов (Y — Cd).
Шестой период (Cs — Rn) содержит 32 элемента. В него, помимо десяти d-элементов (Lu — Hg), включено 14 f-элементов. Элементы от лантана (La) до иттербия (Yb) в виде отдельного ряда вынесены вниз таблицы, который получил название «лантаноиды» по его первому элементу — лантану. Лантаноиды сходны по химическим свойствам. Это объясняется тем, что электронами у них заполняются внутренние 4f-орбитали, а валентный электронный слой имеет похожую электронную конфигурацию — чаще всего 5d16s2. В соединениях лантаноиды проявляют преимущественно степень окисления +3.
Седьмой период также содержит 32 элемента — от франция (Fr) до оганесона (Og). Период начинается с s-элементов (Fr и Ra), затем следуют 14 актиноидов (Ac — No). Эти элементы также вынесены в отдельный ряд внизу таблицы из-за близости их свойств, хотя они выражены меньше, чем у лантаноидов. Затем следуют десять 6d-элементов и шесть 6р-элементов. Все элементы этого периода являются радиоактивными, и большая их часть получена искусственным путём.
В периодической системе элементы разделены на группы. Две группы IA и IIA заполняют s-элементы. Далее располагаются десять В-групп, заполненных d-элементами. Завершают таблицу шесть А-групп, содержащих р-элементы.
Может ли быть открыто ещё больше химических элементов, чем известно сейчас? Ведь самые последние из известных элементов были открыты совсем недавно.
На этот вопрос отвечает теория ядерной физики. Пока с надёжностью предсказывают возможность существования химических элементов с порядковыми номерами до 126. В то же время есть научные концепции, которые предполагают искусственное получение химических элементов с порядковыми номерами до 173 с «островком стабильности» в области 164-го элемента.
У периодического закона нет привычного для физических законов математического выражения. Все попытки вывести математическую формулу периодического закона, предпринимавшиеся неоднократно, оказались безуспешными. В этом особенность свойств химических элементов и их соединений. Присущие им свойства не укладываются в простые математические выражения.
Своеобразной графической формой, выражающей периодический закон, стала периодическая система, которую Д. И. Менделеев представил в виде таблицы. По предложению ИЮПАК её так и называют: «Периодическая таблица элементов» (Periodic Table of the Elements), а у нас часто кратко: «Таблица Менделеева».
Таблица периодической системы — это иллюстрация закономерного расположения химических элементов относительно друг друга в периодической системе.
Менделеев посчитал более приемлемым представить периодическую систему в короткопериодной форме, которая в современном виде изображена на рисунке 20.1. В ней группы элементов подразделяются на подгруппы — главные и побочные. В главных подгруппах размещены s– и p-элементы, в побочных — d-элементы.
Рис. 20.1. Современный вариант короткопериодной периодической системы химических элементов
Позже ИЮПАК предложил использовать полудлиннопериодный вариант таблицы, в котором главные и побочные подгруппы были преобразованы в отдельные А- и В-группы: главные — в А-группы, побочные — в В-группы. Таких групп оказалось 18. Эта таблица изображена на форзаце учебника.
Существует вариант длиннопериодной таблицы, в которой f-элементы встроены в ряд с d-элементами (рис. 20.2). Существуют и другие варианты изображения периодической системы, их насчитывается около 500.
Рис. 20.2. Длиннопериодная форма периодической системы химических элементов
Сила и глубина лечебного действия лантаноидов
Гомеопаты, которые знают Лантаноиды, очень ценят их – силу и глубина лечебного действия лантаноидов превосходят по своим возможностям лекарства из более простых химических элементов. За это действие лантаноидов на организм часто сравнивают с подвигами Геракла.
В качестве примеров можно назвать подвиги:
- Немейский лев
- Лернейская гидра (победил её с помощью своего племянника Иолая)
- Дикий Эриманфский вепрь
- Киринейская лань
- Стимфалийские птицы (Самариум)
- Авгиевы конюшни (победа силой ума)
- Критский бык (Минотавр)
- Кони Диомеда,
- Пояс Ипполиты (Ипполита – царица амазонок)
- Коровы Гериона
- Яблоки Гесперид (вынужден, как титан Атлант держать на плечах небосвод)
- Адский пёс Цербер
- Раб Омфалы. Наградой в состязании лучников была Иола — дочь царя Эврита, но победившему в состязании Гераклу её не отдали.
В конце истории подвигов душа Геракла очищается и становится бессмертной. Он оказывается на Олимпе, где примиряется с Герой.
Я тоже видел действие этих лекарств, так как были случаи, когда вскоре после их приёма у женщин быстро наступала беременность, хотя это и не было основной целью лечения. Редкоземельные элементы – лантаноиды в качестве гомеопатических препаратов (монопрепаратов) в этом тоже могут помогать.
Во время учёбы в медицинском институте я знал одного человека соответствующего по своим особенностям группе лантаноидов, но в то время ещё не был знаком с гомеопатией. То был обычный парень 175 см роста и 70 кг веса. Он рисовал карандашом так, что в портрете нарисованном за 15-20 минут, как будто бы была душа человека. При этом говорил, что лепит ещё лучше чем рисует. Выставки его работ во время учёбы в школе проводились в областном городе.
Но на этом его таланты не заканчивались, он был наделён просто недюжинной силой. На жесткий пружинный экспандер из 5 пружин он добавил ещё 4 пружины и несколько раз растягивал его перед собой на прямых руках. Я тоже попробовал его растянуть, но только двумя руками взявшись за 1 ручку, а на другую наступив ногой – у меня ничего не получилось, было похоже на то, как-будто растягиваешь стальной трос. Вот так скрытые от других внутренне способности лантаноидов помогают им достигать своей цели.
характеристики
Кристаллическая структура лантаноидов, кроме церия, самария, европия и иттербия.
Физические свойства
Лантаноиды – это блестящие, серебристые, относительно мягкие и химически активные металлы. Практически все они имеют наиболее плотную упаковку сфер , характерную для металлов . Твердость увеличивается с увеличением атомного номера.
Подобно актинидам , лантаноиды принадлежат к внутренним переходным элементам или элементам f-блока , поскольку f-орбитали в этих рядах не полностью заполнены электронами.
Все изотопы прометия нестабильны, то есть радиоактивны.
Химические свойства
Из-за схожей структуры валентной оболочки лантаноиды химически ведут себя как элементы 3-й группы скандия и иттрия периодической таблицы и вместе с ними образуют группу редкоземельных элементов . На воздухе они быстро окисляются и тускнеют. Они более или менее быстро реагируют с водой с образованием водорода .
Начиная с Cer, постепенно заполняется орбиталь 4f. В случае лютеция он полностью занят 14 электронами. Поскольку 4f-орбитали лежат глубоко внутри атомов , они мало влияют на химическое поведение в отличие от d-орбиталей других элементов подгруппы. Таким образом, элементы лантаноидов относительно схожи по своим химическим свойствам. Они настолько похожи, что когда в 1794 году была открыта эта земля, их даже считали оксидом одного и того же элемента. То же самое относится и к многочисленным компонентам церитовой земли. Их объединяет степень окисления +3. Кроме того, у некоторых элементов встречаются степени окисления +2 и +4.
Нарушение непрерывности ионных радиусов между гадолинием и тербием называется разрывом гадолиния в лантаноидах. Это объясняет, почему, несмотря на схожесть лантаноидов, химическое поведение элементов меняется после гадолиния. На химическое поведение можно легко повлиять на разрыв гадолиния. Следа америция достаточно, чтобы комплекс тербия приобрел структурный тип более легких лантаноидов.
Цвета ионов лантаноидов в водном растворе
| Число окисления | 57 год | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| +2 | Sm 2+ кроваво-красный | Eu 2+ бесцветный | Тм 2+ пурпурно-красный | Yb 2+ желто-зеленый | |||||||||||
| +3 | La 3+ бесцветный | Ce 3+ бесцветный | Пр 3+ желто-зеленый | Nd 3+ фиолетовый | PM 3+ фиолетовый розовый | Sm 3+ темно-желтый | Eu 3+ бесцветный | Gd 3+ бесцветный | TB 3+ бесцветный | Dy 3+ желто-зеленый | Ho 3+ желтый | He 3+ темно-розовый | TM 3+ бледно-зеленый | Yb 3+ бесцветный | Лю 3+ бесцветный |
| +4 | Ce 4+ оранжево-желтый | Пр 4+ желтый | Nd 4+ сине-фиолетовый | TB 4+ красно-коричневый | Dy 4+ оранжево-желтый |
Общие свойства
Это блестящие металлы с серебристым блеском, которые быстро тускнеют на воздухе. По мере увеличения атомного номера они становятся все менее и менее мягкими . Их температура плавления и кипения выше, чем у большинства металлов, за исключением переходных металлов . Они бурно реагируют с большинством неметаллов и горят на воздухе. Это свойство используется в более легких камнях , которые сделаны из сплава лантаноидов, мишметалла .
Эти элементы не редкость в естественной среде, церий 58 Ce является 26- м или 27- м наиболее распространенным элементом земной коры (содержание того же порядка, что и у меди ). Неодима 60 Nd более многочисленно , чем кобальт , то лютеций 71 Л (менее обильные нерадиоактивные лантаноиды), однако, более обильный , чем серебро , и туллий более обильный , чем йод .
Лантаноиды довольно хорошо подтверждают эффект Оддо-Харкинса , согласно которому элементы с атомным номером больше 4 более распространены во Вселенной, когда их атомный номер четный, чем когда он нечетный.
Элемент Атомная масса Плавление температура Температура кипения массовый объем Атомный радиус Электронная конфигурация Энергия ионизации Электроотрицательность ( Полинг ) Ионный радиус трикации Ln 3+ Лантан 138,90547 ед. 920 ° С 3464 ° С 6,162 г · см -3 187 вечера 6s 2 5d 1 (*) 538,1 кДж · моль -1 1,10 103.2 вечера Церий 140,116 (1) ед. 795 ° С 3443 ° С 6,770 г · см -3 181,8 вечера 6s 2 4f 1 5d 1 (*) 534,4 кДж · моль -1 1,12 102 вечера Празеодим 140.90766 u 935 ° С 3 130 ° С 6,77 г · см -3 182 вечера 6s 2 4f 3 527 кДж · моль -1 1.13 99 вечера Неодим 144 242 (3) u 1,024 ° С 3074 ° С 7,01 г · см -3 181 вечера 6s 2 4f 4 533,1 кДж · моль -1 1.14 98.3 вечера Прометий 1042 ° С 3000 ° С 7,26 г · см -3 183 вечера 6s 2 4f 5 540 кДж · моль -1 1.13 97 вечера Самарий 150,36 (2) ед. 1072 ° С 1900 ° С 7,52 г · см -3 180 вечера 6s 2 4f 6 544,5 кДж · моль -1 1.17 95,8 вечера Европий 151 964 (1) ед. 826 ° С 1529 ° С 5,264 г · см -3 180 вечера 6s 2 4f 7 547,1 кДж · моль -1 1.2 94.7 вечера Гадолиний 157,25 (3) ед. 1312 ° С 3000 ° С 7,90 г · см -3 180 вечера 6s 2 4f 7 5d 1 (*) 593,4 кДж · моль -1 1,20 93.8 вечера Тербий 158.92 535 ед. 1,356 ° С 3,123 ° С 8,23 г · см -3 177 вечера 6s 2 4f 9 565,8 кДж · моль -1 1.2 92.3 вечера Диспрозий 162 500 (1) ед. 1,407 ° С 2,562 ° С 8,540 г · см -3 178 вечера 6s 2 4f 10 573,0 кДж · моль -1 1,22 91.2 вечера Гольмий 164.93033 ед. 1461 ° С 2600 ° С 8,79 г · см -3 176 вечера 6s 2 4f 11 581,0 кДж · моль -1 1,23 90,1 вечера Эрбий 167 259 (3) u 1529 ° С 2868 ° С 9,066 г · см -3 176 вечера 6s 2 4f 12 589,3 кДж · моль -1 1,24 89 вечера Тулий 168.93422 ед. 1545 ° С 1,950 ° С 9,32 г · см -3 176 вечера 6s 2 4f 13 596,7 кДж · моль -1 1,25 88 вечера Иттербий 173 045 ед. 824 ° С 1,196 ° С 6,90 г · см -3 176 вечера 6s 2 4f 14 603,4 кДж · моль -1 1.1 86,8 вечера Лютеций 174.9668 ед. 1,652 ° С 3,402 ° С 9,841 г · см -3 174 вечера 6s 2 4f 14 5d 1 523,5 кДж · моль -1 1,27 86,1 вечера
- (*) Исключения из правила Клечковского : лантан 57 La, церий 58 Ce, гадолиний 64 Gd.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
 Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
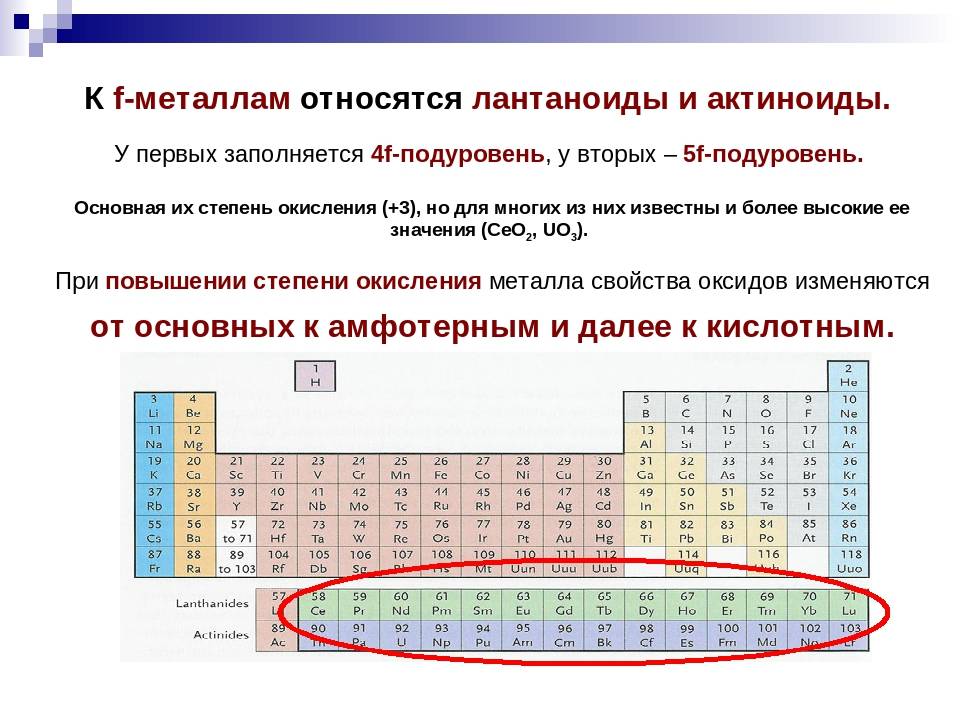
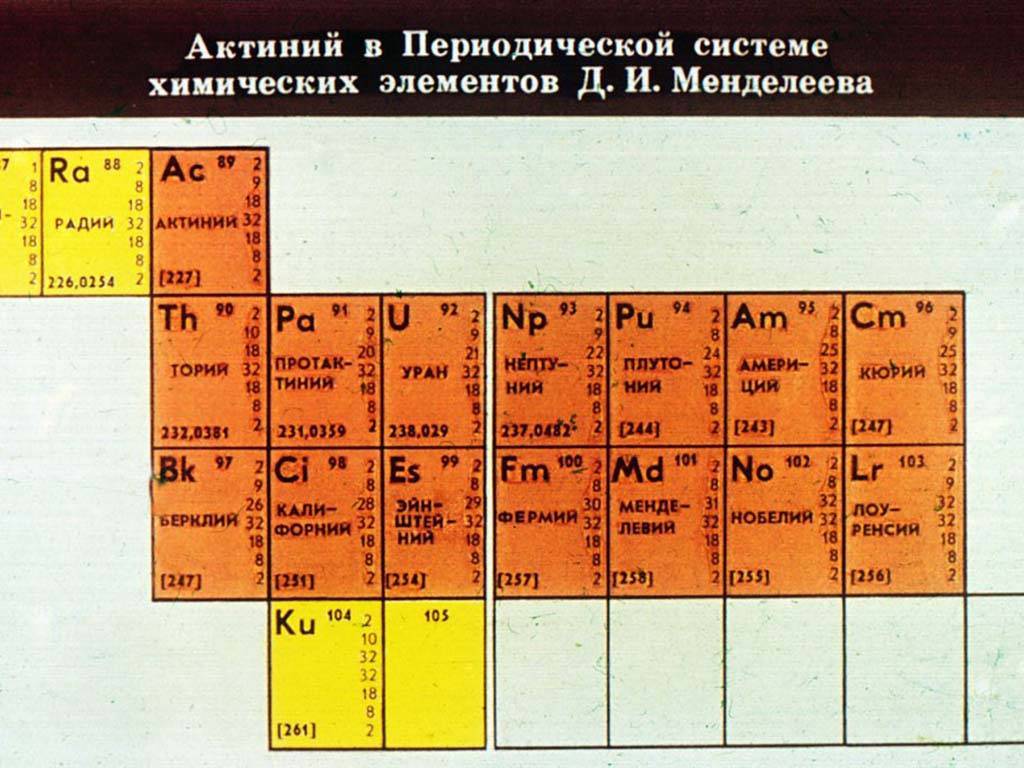
Что такое актиноиды
Актиноиды – это химические элементы, которые можно найти в серии актинидов блока f в периодической таблице элементов. Все актиноиды являются радиоактивными элементами из-за их нестабильной природы. У них нет стабильных изотопов. Эти элементы состоят из очень больших атомов. Актиноиды имеют свои валентные электроны на 5f орбитали. Серия актинидов состоит из химических элементов, имеющих атомные номера от 89 до 103.
Актиноиды высоко электроположительны. Это означает, что у них очень мало или нет сродства к электрону. Так как это очень реактивные элементы, они легко воспламеняются в воздухе. Хотя они и являются металлами, актиноиды очень мягкие. Некоторые из них можно даже порезать ножом.Все актиноиды являются парамагнитными (могут притягиваться внешним магнитным полем).
Рисунок 2: Актиниды
Наиболее распространенными и распространенными актиноидами на земле являются уран и торий. Они слабо радиоактивны и выделяют высокую энергию во время радиоактивного распада. Видное состояние окисления среди актиноидов +3. Кроме того, актиноиды показывают степени окисления, такие как +4, +5 и +6.
Актиноиды образуют основные оксиды и гидроксиды. Они обладают способностью образовывать комплексы с лигандами, такими как хлориды, сульфаты и т. Д. Большинство комплексов актиноидов являются красочными. Однако из-за радиоактивности и поведения тяжелых металлов актиноиды считаются токсичными соединениями.
Примечания и ссылки
- Иногда они написаны лантаноиды в связи с ИЮПАК по рекомендации для вызова этих элементов лантаноиды на английском языке для того , чтобы избежать путаницы с минеральными анионами , которые на английском языке имеют суффикс -ide : фторид для ионов фторида F – , хлорид для ионов хлора Cl – , галогенид для галогенида , сульфида для сульфида и т. д. В английском языке эта рекомендация мало соблюдается, во французском она тем более, тем более что в нашем языке не существует путаницы с минеральными анионами.
- (in) , раздел 1: Основные константы, единицы и коэффициенты преобразования , подраздел: Электронная конфигурация нейтральных атомов в основном состоянии , 84- е онлайн-издание, CRC Press, Бока-Ратон, Флорида, 2003.
- (in) Родерик П. Макдональд , Использование фильтра из оксида гольмия в спектрофотометрии , Clinical Chemistry , Vol. 10, декабрь 1964, стр. 1117-1120
- (in) Альберт К. Левин и Фрэнк С. Палилла , Новый высокоэффективный катодолюминесцентный люминофор с красным светом (YVO 4: Eu) для цветного телевидения » , Applied Physics Letters , vol. 5, п о 6,15 сентября 1964 г., стр. 118-120
- (in) Мэтью Р. Макдональд, Джефферсон Э. Бейтс, Джозеф В. Циллер, Филипп Фурче и Уильям Дж. Эванс , Завершение серии двух ионов лантаноидов для элементов: синтез молекулярных комплексов Pr 2+ , Gd2 +., Tb 2+ и Lu 2+ » , Журнал Американского химического общества , т. 135, п о 26,3 июля 2013 г., стр. 9857-9868
Индивидуальные доказательства
- Вольфганг Либшер, Эккехард Флюк: Систематическая номенклатура неорганической химии . Springer-Verlag, Берлин 1999, ISBN 3-540-63097-X .
- Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 .
- AM Mariano: Экономическая геология редкоземельных минералов . В: Б. Р. Липин, Г. А. Маккей (ред.): Обзоры по минералогии , том 21 – Геохимия и минералогия редкоземельных элементов (1989). Опубликовано Минералогическим обществом Америки, ISBN 0-939950-25-1 , стр. 309-337.
- Георг Штайнхаузер : Структурная химия – Прикосновение к пустоте. В кн . : Новости химии. 66, 2018, стр 118,. DOI : .
- А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 102-е издание. Вальтер де Грюйтер, Берлин 2007, ISBN 978-3-11-017770-1 , стр. 1937.
- ДТВ атлас по химии . 1981 , часть 1. С. 220.
- ↑
Общие способы получения металлов в промышленности
За исключением тория, протактиния и урана, которые добывают прямым путем из руд, остальные актиноиды можно получить путем облучения образцов металлического урана быстродвижущимися потоками нейтронов. В промышленных масштабах нептуний и плутоний добывают из отработанного топлива ядерных реакторов. Отметим, что получение актиноидов – это достаточно сложный и дорогостоящий процесс, основными методами которого являются ионный обмен и многостадийная экстракция. Лантаноиды, которые называют редкоземельными элементами, получают путем электролиза их хлоридов или фторидов. Чтобы добыть сверхчистые лантаноиды, используют металлотермический метод.

Получение лантаноидов
Основной способ получения лантаноидов — восстановление металлов из их окислов водородом или другими восстановителями.
А.Н.Даапе и Ф.Спендинг разработали двухстадийный способ получения элементарного диспрозия. Сначала окись диспрозия превращают в фторид, на который затем действуют металлическим кальцием при быстром нагревании:
Dy 2 O 3 + 6HF → 2DyF 3 + ЗН 2 О 2DyF 3 + ОСА 1500 ? C → 3CaF 2 + 2Dy
Такой способ позволяет получать металл высокой чистоты. Тербий получают, восстанавливая Тb 2 О с кальцием или электролизом расплава ТbС1 3. Благодаря внедрению передовых технологий получения лантаноидов, такие, как ионный обмен, зонная плавка, экстракция, получают металлы с высоким выходом и высокой чистоты.
Теоретически с бромида самария можно выделить чистый металл. Однако при взаимодействии с активными металлами основная масса исходного вещества сублимируется:
SmBr 2 + Ва → Sm + ВаВr 2.
Лантан получают из монацита в несколько стадий. Первая стадия концентрации происходит уже на драге. Плотность монацита 4,9-5,3, а привычного песка — в среднем 2,7 г / см 3. При такой разнице в весе гравитационное разделение не представляет особого труда. Но, кроме монацита, в тех же песках есть другие тяжелые минералы. Поэтому чтобы получить монацитового концентрат чистотой 92-96%, применяют комплекс гравитационных, магнитных и электростатических методов обогащения. В результате попутно получают ильменитовый рутил, цирконовые и другие ценные концентраты.
Как и всякий минерал, монацит надо «раскрыть». Чаще монацитового концентрат обрабатывают для этого концентрированной серной кислотой. Сульфаты редкоземельных элементов и тория, образующиеся выщелачивают обычной водой. После того, как они перейдут в раствор, в осадке остаются кремнезем и часть циркона, не отделилась на предыдущих стадиях.
На следующей стадии разделения извлекают короткоживущих радий-228, а затем и торий — иногда вместе с церием, иногда отдельно. Отделение церия от лантана и смеси Ланта-ноиды не особо сложное: в отличие от них, он способен проявлять валентность 4 + и в виде гидроксида Се (ОН) 4 переходить в осадок, тогда как его трехвалентные аналоги остаются в растворе. Стоит отметить, что операция отделения церия, как, впрочем, и предыдущие, проводится много раз — чтобы как можно полнее «выжать» дорогой редкоземельный концентрат.
После того, как церий, выделенный в растворе всего лантана (в виде нитрата Lа (NO 3) 3, поскольку на одной из промежуточных стадий серная кислота была заменена азотной, чтобы облегчить дальнейшее разделение). Из этого раствора и получают лантан, добавляя аммиак, нитраты аммония и кад-мию. При наличии Сd (NO 3) 2 разделение более полно. С помощью этих веществ все лантаноиды переходят в осадок, в фильтрате же остаются лишь кадмий и лантан. Кадмий облагаются сероводородом, отделяют осадок, а раствор нитрата лантана еще несколько раз очищают дробной кристаллизацией от примесей лантаноидов.
Таким образом, получают хлорид лантана LаС1 3 -. Электролизом расплавленного хлорида дает лантан чистотой до 99,5%. Еще чище лантан (99,79% и выше) получают кальциетермичним способом. Такая традиционная классическая технология.
В честь малой планеты
Cerium
Церий. (Cerium, Се, порядковый номер 58, атомный вес 140,13).
Этот металл, вернее, «цериевая земля», была открыта в 1803 году Якобом Берцелиусом и В. Гизенгером. Но чистым он был получен лишь много лет спустя. Почему у него такое имя? Накануне, итальянским астрономом Дж. Пиацци была обнаружена самая крупная из малых планет солнечной системы — Церера. В память этого события и окрестили химики вновь открытый элемент.
Церий первым из редких земель нашел практическое применение. Известный австрийский ученый Ауэр фон Вельсбах начал добавлять его двуокись в колпачки газовых горелок, долгое время применявшихся для освещения улиц и зданий. Затем его стали вводить в сплав, обладающий так называемыми пирфорными свойствами. Если от него откалывать мельчайшие кусочки, то они самопроизвольно воспламеняются. Это свойство сплава стало использоваться в зажигалках, им наполняют трассирующие снаряды и пули.
Выяснилось также, что церий хорошо поглощает азот, водород и кислород. Поэтому с его помощью из жидкого металла начали удалять растворенные в нем и в виде окислов эти газы. Он является сильным восстановителем, и используется для получения чистого ниобия, вольфрама и других металлов. Церий облагораживает чугун, сталь, хром, никель, снижает удельное сопротивление электрическому току алюминия, делает жаропрочным магний. Он увеличивает стойкость турбины реактивного двигателя, творит настоящие чудеса в стекольной промышленности. Небольшие добавки окиси церия (2 —4 процента) делают стекло совершенно непроницаемым для ультрафиолетовых лучей. Смотровые стекла атомных реакторов также содержат его. Они не теряют прозрачности под действием радиации и защищают от нее обслуживающий персонал. Соли церия используются для окраски кожи, делают водонепроницаемыми ткани и изделия.
Церий, его соли и соединения нашли широкое применение в медицине в качестве лекарств, а также в виде добавок к стали, идущей на изготовление искусственных зубов.
На Земле церия много: в пять раз больше свинца, в 250 раз больше серебра.
Лантан без лантаноидов
Как ни грустно сознавать, герой нашего рассказа — личность вполне заурядная. Это металл, обыкновенный по внешнему виду (серебристо-белый, покрытый сероватой окисной пленкой) и по физическим свойствам: температура плавления 920, кипения 3469° С; по прочности, твердости, электропроводности и прочим характеристикам металл лантан всегда оказывается в середине таблиц. Обыкновенен лантан и по химическим свойствам. В сухом воздухе он не изменяется — окисная пленка надежно защищает от окисления в массе. Но если воздух влажен (а в обычных земных условиях он влажен почти всегда), металлический лантан постепенно окисляется до гидроокиси. La(OH)3 — основание средней силы, что опять-таки характерно для металла-«середнячка».
церий
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Название с намеком: оно происходит от греческого A,av0dveiv — скрываться, забываться. Лантан, содержащийся в церите, успешно скрывался от химиков в течение 36 лет! Долгое время считали, что лантан двухвалентен, что он аналог кальция и других щелочноземельных металлов, а его атомный вес равен 90—94. В правильности этих цифр не сомневались до 1869 г. Менделеев же увидел, что во II группе периодической системы редкоземельным элементам нет места и поставил их в III группу, приписав лантану атомный вес 138—139. Но правомерность такого перемещения еще надо было доказать. Менделеев предпринял исследование теплоемкости лантана. Полученная им величина прямо указывала на то, что этот элемент должен быть трехвалентным… Металлический лантан, разумеется, далеко не чистый, впервые был получен Мозандером при нагревании хлористого лантана с калием. В наше время в промышленных масштабах получают лантан чистотой более 99%. Проследим, как это делается, но прежде познакомимся с главными минералами лантана и первыми стадиями сложнейшего процесса разделения редкоземельных элементов. Уже упоминалось, что в минералах лантан и лантаноиды неизменно сопутствуют друг другу. Есть минералы селективные, в которых доля того или иного редкоземельного элемента больше, чем обычно. Но нет минералов чисто лантановых или чисто цериевых, не говоря уже о других лантаноидах. Примером селективного лантанового минерала может служить давидит, в котором до 8,3% Lа203 и лишь 1,3% окиси церия. Но получают лантан преимущественно из монацита и бастнезита, как, впрочем, и церий, и все остальные элементы цериевой подгруппы. Монацит — тяжелый блестящий минерал, обычно желто-бурый, но иногда и других цветов, поскольку постоянством состава он не отличается. Точнее всего его состав описывает такая странная формула: (РЗЭ)Р04. Она означает, что монацит — фосфат редкоземельных элементов (РЗЭ). Обычно в монаците 50—68% окислов РЗЭ и 22—31,5% Ра05. А еще в нем до 7% двуокиси циркония, 10% (в среднем) двуокиси тория и 0,1—0,3% урана. Эти цифры со всей очевидностью показывают, почему так тесно переплелись пути редкоземельной и атомной промышленности. Смешанный металл редких земель — мишметалл — и смесь их окислов начали применять в конце прошлого века, а в начале нынешнего в связи с ними был /продемонстрирован выдающийся образец международного воровства. Немецкие суда, доставлявшие грузы в Бразилию, собираясь в обратный путь, заполняли трюмы песком с пляжей Атлантического побережья этой страны, причем из определенных мест. Капитаны заявляли, что песок — это просто балласт, необходимый для большей устойчивости судна. В действительности же они, выполняя заказы германских промышленников, крали ценное минеральное сырье — прибрежные пески штата Эспириту-Санту, богатые монацитом… Монацитовые россыпи распространены по берегам рек, озер и морей на всех континентах. В начале века (данные за 1909 г.) 92% мировой добычи редкоземельного сырья, и прежде всего монацита, приходилось на долю Бразилии. Спустя десять лет центр тяжести переместился на тысячи километров к востоку (или к западу, смотря как считать) — в Индию. После 1950 г. в связи с развитием атомной промышленности гегемоном среди капиталистических стран в добыче и переработке редкоземельного сырья стали Соединенные Штаты.
циркона432Кадмий3празеодима
К 1965 г. внешнеторговые организации нашей страны могли предложить покупателям все лантаноиды в виде металлов чистотой выше 99%. Кроме прометия, разумеется, хотя радиоактивные препараты этого элемента — продукты ядерного распада урана — тоже стали вполне доступны. В каталоги «Техснабэкспорта» вошли также около 300 химически чистых и особо чистых соединений лантана и лантаноидов. Это свидетельство высокого уровня развития советской редкоземельной промышленности. Но вернемся к лантану.