Получение тугоплавких материалов
Как отмечалось ранее, основной препятствующий фактор производству жаропрочных металлов их высокая химическая активность, препятствующая выделению элементов в чистом виде.
Основной технологией получения остается порошковая металлургия. Данная методика позволяет получать порошки тугоплавких металлов различными способами:
- Восстановление триоксидом водорода. Процесс производится в несколько этапов, внутри многотрубных печей при 750 – 950 °С. Технология применима под порошки тугоплавких металлов: вольфрам и молибден.
- Восстановлением водородом перрената. Схема реализуется в производстве металлического рения. Рабочие температуры составляют около 500 °С. Заключительная стадия предусматривает отмывание порошка от щелочи. Для этого последовательно используется горячая вода и раствор соляной кислоты.
- Использование солей металлов. Технология развита для выделения молибдена. Основным сырьем выступает аммонийная соль металла и его металлический порошок, вводимый в смесь на уровне 5 – 15% от массы. Состав проходит термическую обработку 500 – 850 °С в проточном инертном газе. Восстановление металла проходит в атмосфере водорода при температурах 800 – 1000 °С.

Производство тугоплавких металлов – порошковая металлургия

Экскурсия на производство
Способы получения жаропрочных металлов продолжают совершенствоваться, как и химическая технология тугоплавких неметаллических и силикатных материалов, что связано с развитием ядерной энергетики, авиастроения, появлением новых моделей ракетных двигателей.
Одно из крупнейших предприятий по производству вольфрама на территории РФ – унечский завод тугоплавких металлов. Этот предприятие относительно молодое, строительство его началось в 2007 году на территории населенного пункта Унеча. Производственный акцент завода направлен на порошки тугоплавких металлов, точнее вольфрама и его карбидов.
В дальнейшем, для получения слитков рассыпчатую массу спекают или сдавливают прессом. Подобным образом порошки тугоплавких металлов обрабатываются для производства жаропрочных изделий.
Тяжелые вольфрамовые сплавы
Вольфрам — самый тугоплавкий металл из известных человечеству. Он также имеет очень высокую плотность, одну из самых высоких среди металлов, что, в свою очередь, наделяет вольфрам отличными радиационно-защитными свойствами
Тугоплавкость и высокая плотность — эти два основных свойства и определили его чрезвычайную важность в современных технологиях и направления его использования
Но современные направления науки и техники порой требуют от тугоплавких металлов, и в частности, от вольфрама, такой совокупности свойств, которую вольфрам в чистом виде не силах обеспечить. К примеру, часто возникает необходимость изготовления деталей очень сложной формы. Вольфрам является довольно хрупким материалом при нормальных условиях, что делает его обработку затруднительной. Другой пример — высокая электропроводность при высоких температурах. Электропроводность вольфрама не сравнится с электропроводностью меди, но при высоких температурах медные контакты использовать просто невозможно.
Поэтому в таких случаях применяют так называемые тяжелые сплавы на основе вольфрама или просто вольфрамовые сплавы.Чаще всего это сплавы вольфрама с никелем, железом, медью или сразу с несколькими металлами. Содержание вольфрама, как правило, составляет от 90% до 98% по массе. Фактически, это не совсем сплавы, а так называемые псевдосплавы. Такое название они получили из-за особенностей технологии их производства. Дело в том, что входящие в состав вольфрамовых псевдосплавов компоненты имеют существенно различные физические свойства, главным образом, температуру плавления. Сделать из них сплав в привычном понимании почти невозможно, т.к. при температуре плавления вольфрама большинство металлов находятся в состоянии газов или летучих жидкостей. Поэтому псевдосплавы изготавливают методом порошковой металлургии. Порошки компонентов псевдосплава смешиваются, прессуются и спекаются в присутствии жидкой фазы более легкоплавких металлов и твердой фазы вольфрама. Медь, никель и железо служат связующим веществом для вольфрамовых зерен, что обеспечивает увеличение пластичности, обрабатываемости и электропроводности.
Марки вольфрамовых сплавов, получивших наибольшую популярность в России:
- ВНЖ 7-3 (с содержанием 7% никеля и 3% железа)
- ВНЖ-95 (с содержанием 3% никеля и 2% железа)
- ВНЖ-97.5 (с содержанием 1.5% никеля и 1% железа)
- ВНМ 5-3 (с содержанием 5% никеля и 3% меди)
- ВНМ 3-2 (с содержанием 3% никеля и 2% меди)
- ВНМ 2-1 (с содержанием 2% никеля и 1% меди)
- ВД-20 (с содержанием 80% вольфрама и 20% меди)
- ВД-25 (с содержанием 75% вольфрама и 25% меди)
- ВД-30 (с содержанием 70% вольфрама и 30% меди)
Некоторые области применения вольфрамовых сплавов:
Главные области применения вольфрамовых сплавов определяются их свойствами. К примеру, одним из важнейших свойств вольфрамовых сплавов являются высокие показатели радиационной защиты, что главным образом определяется высокой плотностью этих сплавов (вольфрамовые сплавы более чем в 1,5 раза тяжелее свинца). Тяжелые вольфрамовые сплавы были признаны лучшим материалом для защиты от гамма-излучения, по сравнению с традиционными свинцом, сталью, чугуном и водой. Данное свойство обусловило широкое применение сплавов ВНЖ и ВНМ в следующих областях:
- Емкости, контейнеры для хранения радиоактивных веществ
- Детали приборов радиоактивного каротажа
- Оборудование неразрушающего контроля
- Дозиметрическое оборудование и радиационный контроль
- Коллиматоры, защитные экраны и другие детали различного оборудования

Кроме этого, вольфрамовые сплавы широко применяются для изготовления различного рода утяжелителей, электрических контактов, а также комплектующих продукции оборонной промышленности.
Помимо вольфрамовых псевдосплавов, также получили распространение и сплавы на основе молибдена.
ООО «ЕРГАРДА» изготовит изделия любой сложности из вольфрамовых сплавов по Вашему заказу.
Профессиональные вредности
В. и его соединения (WO2, WO3, H2WO4, Na2WO4•2Η2O) применяются в металлургической промышленности (получение вольфрамовой стали, сверхтвердых сплавов), в электротехнической промышленности (изготовление нитей электроламп, электродов, контактов и т. д.), в хим. промышленности (изготовление кислотоупорных сплавов, катализаторов) и т. д. Токсическое действие различных соединений В. на организм человека неодинаково. Металлический В., карбид В. и особенно ангидрид вольфрамовой к-ты (WO3) вызывают изменения в легких в виде разрастания лимфогистиоцитарных элементов в периваскулярной ткани, утолщения межальвеолярных перегородок за счет пролиферации круглоклеточных элементов.
Описан случай отравления вольфрамовым ангидридом экспериментатора при плавке 70—80% вольфрамовой стали . Через 2 дня после плавки — слабость, лихорадка, через 10 дней состояние больного ухудшилось: повысилась температура, появилась сердечно-сосудистая недостаточность, коревидная сыпь, белок в моче. Выздоровление шло медленно.
3. С. Каплун и Н. В. Мезенцева (1959) при обследовании рабочих, имеющих контакт с В. и его соединениями, отметили изменения только со стороны органов дыхания. В нескольких случаях рентгенологически были установлены начальные явления диффузного пневмосклероза (см.): умеренное расширение и уплотнение корней легких, усиление бронхо-сосудистого рисунка. Значительно более выраженные изменения вызывает попадание в организм пыли твердых сплавов, содержащей карбиды вольфрама и кобальта. Отмечено поражение верхних дыхательных путей, наличие бронхитов, начальных явлений пневмосклероза, гипотония и изменения крови. При длительном контакте с карбонилом В. отмечалось расслаивание и ломкость ногтей, шелушение кожи. Известен случай появления синевато-красной окраски, узелков и чешуек на коже кистей рук у работницы в производстве ламп с вольфрамовыми элементами.
Уколы вольфрамовой проволокой заживают с трудом, при этом часто возникает панариций.
При попадании в организм металлического В. последний не всасывается в кишечнике. Растворимые соединения В. могут откладываться в кишечнике, костях, меньше — в селезенке, коже; следы В. были обнаружены в ткани почек .
Профилактика профессиональных заболев а-н и й, вызванных действием В. и его соединений, направлена прежде всего на борьбу с пылевыделениями путем герметизации оборудования, механизации загрузки и выгрузки материалов, применения эффективной местной вытяжной вентиляции и средств индивидуальной защиты (респираторов).
К работе с В. не допускаются лица с выраженными хрон, изменениями верхних дыхательных путей, хрон, воспалениями конъюнктивы, роговой оболочки, слезных путей, век, а также с экземой или дерматитом лица и рук.
Периодические медосмотры предусмотрены 1 раз в 12 мес. и проводятся с участием терапевта, невропатолога, оториноларинголога; проводится клинический анализ крови и рентгенография грудной клетки. Диагностическое значение имеет определение В. в биол, средах.
Предельно допустимая концентрация В., карбида В. в воздухе рабочей зоны — 6 мг/м3.
Определение вольфрама в крови проводят колориметрическим методом; В. из мочи предварительно осаждают танином (X. Я. Венгерская, 1961).
Библиогр.: Венгерская X. Я. Определение малых количеств вольфрама в крови и моче, Лаборат, дело, № 6, с. 19, 1961; Вредные вещества в промышленности, под ред. Н. В. Лазарева, т. 2, с. 492, Л., 1971, библиогр.; Израэльсон З.И., Могилевская О. Я. и Суворов С. В. Вопросы гигиены труда и профессиональной патологии при работе с редкими металлами, М., 1973; H e к р а-с о в Б. В.Основы общей химии, т. 1—2, М., 1973; P e ми Г. Курс неорганической химии, пер. с нем., т. 2, с. 126 и др., М., 1974; Спиридонова В. С. Вопросы гигиены труда и промышленной токсикологии в производстве хлоридов вольфрама, молибдена и циркония, Гиг. труда и проф. заболев., № 3, с. 45, 1967, библиогр.
Г.М.Пархоменко;Р.К. Моторкина (биохим ).
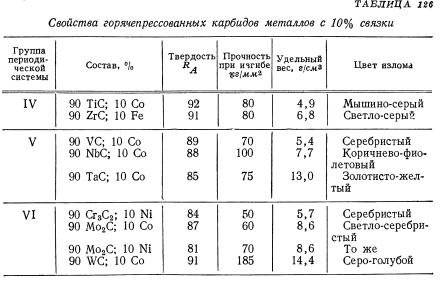
(3) КАРБИДНЫЙ СПЛАВ ТИПА
Эти марки в основном используются для резки стальных деталей, которые обычно имеют содержание кобальта в 5-10% и диапазон размеров зерен 0,8-2 мкм. Добавляя от 4% до 25% карбида титана (TiC), склонность карбида вольфрама (WC) диффундировать к поверхности стального лома может быть уменьшена. Прочность инструмента, износостойкость кратера и сопротивление термическому удару можно улучшить, добавив не более 25% карбида тантала (TaC) и карбида ниобия (NbC). Добавление таких кубических карбидов также увеличивает покраснение инструмента, что помогает избежать термической деформации инструмента во время сверхпрочной резки или другой обработки, когда режущая кромка может создавать высокие температуры. Кроме того, карбид титана может обеспечить места зародышеобразования во время спекания, улучшая однородность распределения кубического карбида в заготовке.
В целом, сплавы типа карбида имеют диапазон твердости HRA91-94 и прочность на разрыв в поперечном направлении 150-300 тыс.фунтов / кв.дюйм. По сравнению с простым типом износостойкость сплава имеет низкую износостойкость и низкую прочность, но его износостойкость лучше. Сплавы сплавов могут быть разделены на C5-C8 в системе класса С и могут классифицироваться в соответствии со стандартами класса P и M в системе качества ISO. Сплавы сплавов с промежуточными свойствами можно классифицировать как общие классы (например, C6 или P30) для токарной обработки, нарезания резьбы, строгания и фрезерования. Самые твердые сорта могут быть классифицированы как мелкие сорта (например, C8 и P01) для отделки и расточки. Эти сорта обычно имеют меньший размер зерна и более низкое содержание кобальта для достижения желаемой твердости и износостойкости. Однако аналогичные свойства материала могут быть получены путем добавления большего количества кубических карбидов. Наиболее устойчивые марки могут быть классифицированы как грубые (например, C5 или P50). Эти сорта обычно имеют средний размер частиц и высокое содержание кобальта, а количество добавленного кубического карбида также мало для достижения желаемой вязкости за счет ингибирования распространения трещины. В прерванном процессе поворота эффективность резания может быть дополнительно улучшена за счет использования богатого кобальтом сорта, имеющего более высокое содержание кобальта на поверхности резака.
Сплавы сплавов с низким содержанием карбида титана используются для обработки нержавеющей стали и ковкого чугуна, но могут также использоваться для обработки цветных металлов (таких как суперсплавы на основе никеля). Эти сорта обычно имеют размер зерна менее 1 мкм и содержание кобальта от 8% до 12%. Сорта с более высокой твердостью (например, M10) могут использоваться для обработки ковкого чугуна; марки с лучшей ударной вязкостью (например, M40) могут использоваться для фрезерования и строгания стали или для обработки нержавеющей стали или суперсплавов.
Сплавы карбида сплава также могут использоваться для неметаллической резки, прежде всего для изготовления износостойких деталей. Эти сорта обычно имеют размер частиц 1,2-2 мкм и содержание кобальта 7% -10%. При производстве этих сортов обычно добавляется большая доля переработанных материалов, что приводит к повышению экономической эффективности при применении изношенных деталей. Изношенные детали требуют хорошей коррозионной стойкости и высокой твердости. Эти марки могут быть получены путем добавления никеля и карбида хрома при производстве таких сортов.
Изотопы
Известны изотопы вольфрама с массовыми числами от 158 до 192 (количество протонов 74, нейтронов от 84 до 118), и более 10 ядерных изомеров.
Природный вольфрам состоит из смеси пяти изотопов ( 180 W — 0,12(1)%, 182 W — 26,50(16) %, 183 W — 14,31(4) %, 184 W — 30,64(2) % и 186 W — 28,43(19) %). В 2003 открыта чрезвычайно слабая радиоактивность природного вольфрама (примерно два распада на грамм элемента в год), обусловленная α-активностью 180 W, имеющего период полураспада 1,8⋅10 18 лет.
- Вольфрам (W)
- Арсенид вольфрама (WAs2) Вольфрам мышьяковистый
- Борид вольфрама (WB) Вольфрам бористый
- Борид дивольфрама (W2B) Бористый вольфрам
- Бромид вольфрама II (WBr2) Вольфрам бромистый
- Бромид вольфрама III (WBr3)
- Бромид вольфрама IV (WBr4) Бромистый вольфрам
- Бромид вольфрама 5 (WBr5)
- Бромид вольфрама VI (WBr6)
- Вольфрамит ((FeMn)WO4)
- Вольфрамовая кислота (H2WO4) Ортовольфрамовая кислота
- Гексакарбонилвольфрам (W(CO)6)
- Диборид вольфрама (WB2)
- Динитрид вольфрама (WN2)
- Диоксидибромид вольфрама (WO2Br2) Бромистый вольфрамил
- Диоксидихлорид вольфрама (WO2Cl2) Хлористый вольфрамил
- Дисилицид вольфрама (WSi2) Кремнистый вольфрам
- Дисульфид вольфрама (WS2) Сернистый вольфрам
- Дифосфид вольфрама (WP2) Фосфористый вольфрам
- Дифосфид тетравольфрама (W4P2)
- Йодид вольфрама II (WI2) Вольфрам йодистый
- Йодид вольфрама III (WI3)
- Йодид вольфрама IV (WI4) Йодистый вольфрам
- Карбид вольфрама (WC) Вольфрам углеродистый
- Карбид дивольфрама (W2C) Углеродистый вольфрам
- Нитрид дивольфрама (W2N) Вольфрам азотистый
- Оксид вольфрама IV (WO2) Окись вольфрама
- Оксид вольфрама VI (WO3) Вольфрам окись
- Окситетрабромид вольфрама VI (WOBr4) Бромокись вольфрама
- Окситетрафторид вольфрама VI (WOF4) Фторокись вольфрама
- Окситетрахлорид вольфрама VI (WOCl4) Хлорокись вольфрама
- Пентаборид дивольфрама (W2B5)
- Селенид вольфрама IV (WSe2) Вольфрам селенистый
- Селенид вольфрама VI (WSe3) Селенистый вольфрам
- Силицид вольфрама (W2Si3) Вольфрам кремнистый
- Теллурид вольфрама IV (WTe2) Вольфрам теллуристый
- Тринитрид дивольфрама (W2N3) Азотистый вольфрам
- Трисульфид вольфрама (WS3) Вольфрам сернистый
- Фенолят вольфрама (WC36H30O6)
- Фосфид вольфрама (WP) Вольфрам фосфористый
- Фторид вольфрама IV (WF4) Вольфрам фтористый
- Фторид вольфрама 5 (WF5)
- Фторид вольфрама VI (WF6) Фтористый вольфрам
- Фтороксивольфраматы
- Хлорид вольфрама II (WCl2) Вольфрам хлористый
- Хлорид вольфрама III (WCl3)
- Хлорид вольфрама IV (WCl4)
- Хлорид вольфрама 5 (WCl5)
- Хлорид вольфрама VI (WCl6) Хлористый вольфрам
- Шеелит (CaWO4)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Применение
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам
Нить накаливания
- Тугоплавкость вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперённых снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твёрдостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолётов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах или более эффективной при равном весе. Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др. либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе.
Соединения вольфрама
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка, которая обладает высокой влагостойкостью и нагревостойкостью.
- Некоторые соединения вольфрама применяются как катализаторы и пигменты.
- Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
- Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К).
Другие сферы применения
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества.
Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Примечания
- ↑ 123Косолапова Т. Я. Карбиды. — Металлургия, 1968. — С. 300.
- ↑ 1 2 3Третьяков В. И. Основы металловедения и технологии производства спеченных твердых сплавов. — Металлургия, 1976. — С. 24-268. — 528 с.
- Тот Л. Карбиды и нитриды переходных металлов. — Мир, 1974. — С. 21-23. — 296 с.
- Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 420-421. — 623 с. — 100 000 экз.
- ↑ 12Самсонов Г. В. Физическое материаловедение карбидов. — Наукова думка, 1974. — С. 79-397. — 454 с.
- Киффер Р., Бенезовский Ф. Твердые сплавы. — Металлургия, 1971. — С. 47. — 392 с.
- ↑ 12Самсонов Г. В., Виницкий И. М. Тугоплавкие соединения (справочник). — Металлургия, 1976. — С. 560.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. — Химия, 2000. — С. 330. — 480 с.
- Литера H (Hartkern) в обозначении германских боеприпасов ВМВ означает «с твёрдым металлокерамическим сердечником».
- Так 20-мм БПС марки DM43 при стрельбе из пушки MK 20 RH 202 (начальная скорость 1100 м/с) на дальности 1000 м способен пробить 35 мм стальной брони при угле соударения 0°, и лишь 8 мм брони при угле 60°. Jane’s Infantry Weapons 1996-97, 456.
- Дмитрий Сафин. [science.compulenta.ru/570052/ Представлен малозатратный способ электролитического получения водорода] (рус.). Компьюлента (15 октября 2010). — Подготовлено по материалам Wiley. Проверено 16 октября 2010.
- [www.nanorf.ru/events.aspx?cat_id=223&d_no=1389&print=1&back_url=%2fevents.aspx%3fcat_id%3d223%26d_no%3d1389 15.04.2009 Опасна ли для здоровья нанопыль карбида вольфрама?] Российский электронный наножурнал (нанотехнологии и их применение)
- [www.microelements.ru/W Вольфрам. W.]
ПРИМЕНЕНИЕ
 Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
Вольфрам используют в качестве электродов для аргоно-дуговой сварки. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей. Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам. ( Р18, Р6М5. от rapid – быстрый, скорость).
Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка. Некоторые соединения вольфрама применяются как катализаторы и пигменты. Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К). Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
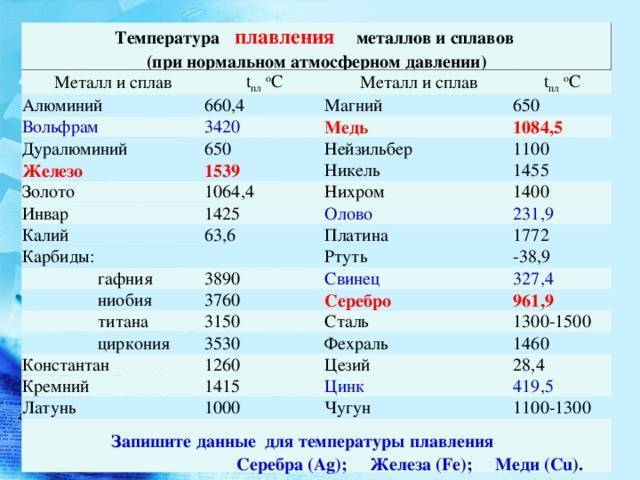
Вольфрам (англ. Tungsten) – W
| Молекулярный вес | 183,84 г/моль |
| Происхождение названия | лат. Spuma lupi («волчья пена») или нем. Wolf Rahm (“волчьи сливки”, “волчий крем”) |
| IMA статус | подтвержден в 2011 году |
Вольфрам — самый тугоплавкий металл
Вольфрам — простое химическое вещество, элемент таблицы Менделеева, переходный металл. Записывается в виде латинской буквы W. Название получил от минерала вольфрамит, известного рудокопам с 16-го века. Сам минерал Wolf Rahm (в переводе с немецкого — «волчья пена») получил свое название из-за того, что осложнял получение олова из оловосодержащих пород. При выплавке примеси вольфрама образовывали соединения с оловом и поднимались на поверхность в виде пены; на языке рудокопов «пожирают олово как волк овцу».
Относится к редким элементам, по распространенности на планете занимает 57-е место. Встречается только в минералах, состоящих из соединений разных металлов. В добывающей индустрии наиболее значимы вольфрамит, шеелит, фербелит, гюбнерит. В месторождениях концентрация вольфрама редко превышает 2%.
Как отдельный химический элемент вольфрам был открыт в конце XVIII века. Известный шведский химик К. Шееле проводил эксперименты с минералом тунгстен (позже переименованным в его честь и названным шеелитом). Обработав его азотной кислотой, ученый выяснил, что образец представляет собой соль неизвестной кислоты. Его ученики продолжили работы с интересным минералом и через два года настойчивых исследований выделили неизвестный науке металл, который назвали вольфрамом. Большого шума это открытие не вызвало, т.к. новый металл был чрезвычайно тугоплавким и в мире просто еще не существовало печей, способных обеспечить необходимую температуру для выплавки. Зато в ХХ веке вольфрам произвел в промышленности настоящую революцию.
|
|
| Электропечи с максимальной температурой нагрева +1300 °С | Электропечи с максимальной температурой нагрева +1100 °С |
Свойства
Светло-серебристый блестящий металл, напоминающий платину. Очень плотный, тяжелый, твердый, но, при этом, хрупкий. Плавится при t около +3400 °C, это самый высокий показатель среди металлов. (Теоретически более тугоплавким может быть трансактиноид сиборгий, но это короткоживущий радиоактивный элемент №106, получаемый искусственно в результате ядерного синтеза.) В нормальных условиях вольфрам плохо поддается механической обработке, зато при нагреве свыше +1600 °С его можно ковать, прокатывать, вытягивать в тонкую нить. Парамагнетик (может намагничиваться во внешнем магнитном поле), обладает высоким электрическим сопротивлением.
В химических реакциях может проявлять валентность от 2 до 6, но все устойчивые соединения образованы W (VI). При температуре в районе +20 °С не поддается коррозии в воде и на воздухе. Очень слабо реагирует с соляной, фтороводородной и неконцентрированной серной кислотами. А вот с перекисью водорода, азотной кислотой, смесью азотной и фтороводородной кислот, «царской водкой» взаимодействует легко. При высокой t и в присутствии окислителей вступает в реакции со щелочами. Образует оксиды, вольфраматы (соли вольфрамовых кислот), соединения с галогенами, серой, углеродом.
В метаболизме животных и человека не участвует.
Вольфрамовая пыль, как и пыль любого другого металла, оказывает раздражающее влияние на органы дыхания.
Это интересно
На Земле существует несколько типов архебактерий и бактерий, использующих в своих обменных процессах ферменты с вольфрамом. Ученые считают, что они ведут свое развитие с ранней архейской эры (около 4 млрд. лет назад), когда этот металл играл важную роль в создании и развитии жизни на планете.
Вольфрам — крайне востребованный в промышленности металл. Подробнее о его применении мы расскажем в следующей статье.
Основные металлические карбиды
На практике широко применяется множество карбидных соединений. Рассмотрим основные из них.
Карбид гафния
Встречается в виде только одного вещества — HfC. В нормальных условиях обладает кристаллической структурой, окрашено в серый цвет. плавится при температуре 3900 градусов — интересно, что его закипание происходит уже при температуре 4160 градусов. Поэтому к расплавлению нужно подходить аккуратно, чтобы не испарить его. При нагреве до 2000 градусов начинает взаимодействовать с металлами (молибден, вольфрам). Вещество не обладает полной химической инертностью — оно вступает в реакцию с кислотами (в азотной или серной кислоте оно способно полностью раствориться).

Карбиды хрома
Встречается в виде нескольких веществ; основные — Cr23C6, Cr3C2, Cr7C3. Отличаются высокой химической инертностью (хотя могут реагировать с цинком при сильном нагреве). Не вступают в контакт с водой, атмосферным воздухом, кислотами, щелочами, солями, другими карбидными соединениями. Температура плавления не слишком высокое — большинство соединений плавятся уже при температуре 1500-1700 градусов. У соединения Cr7C3 при нагреве до 800 градусов происходит ряд эндотермических реакций и превращений, что приводит к превращению вещества в Cr23C6.
Карбид титана
Встречается в виде одного стабильного соединения — TiC. При нормальных условиях обладает серым цветом с характерным металлическим блеском. Плавится при температуре 3100 градусов, кипит — при 4305 градусах. Обладает высокой устойчивостью, прочностью. Химическая инертность средняя — в нормальном состоянии может вступать в реакцию с кислотами и щелочами (хотя реакция идет слабо). При нагреве до 2500 градусов может вступать в реакцию с азотом (в том числе — атмосферным). При нагреве до 1200 градусов может окисляться и/или вступать в реакцию с углекислым газом.
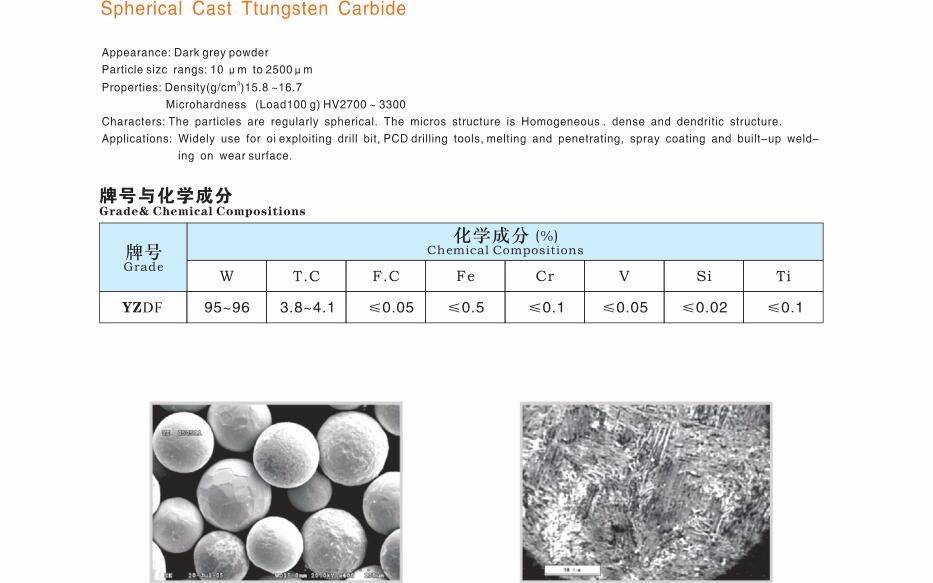
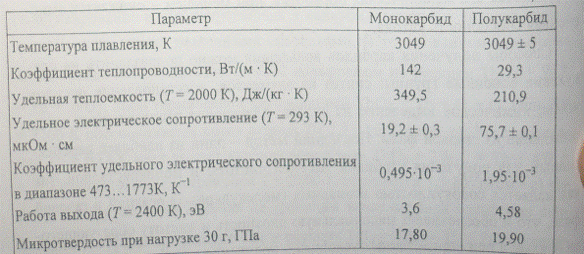
Карбиды вольфрама
Встречается в виде двух устойчивых соединений — WC и W2C. Оба карбида отличаются приблизительно одинаковыми химико-физическими свойствами. Вид — мелкий порошок серовато-черного цвета (со слабым металлическим блеском или без него). Вещества плавятся при температуре около 2720 градусов, однако при более низких температурах начинается их активных контакт с атмосферным воздухом, азотом или углекислым газом. Соединения легко растворяются в разогретых до температуре кипения серных и азотных кислотах.
Карбид кальция
Основное устойчивое соединение — CaC2. Вид — крупные прозрачные кристаллы, которые могут обладать светло-голубым оттенком. При наличии примесей может окрашиваться в другие цвета — серый, желтый, коричневый, черный и другие (в зависимости от типа примеси и ее концентрации). Соединение плавится при температуре порядка 2500 градусов, однако при комнатной температуре оно активно вступает в реакцию с водой с активным выделением ацетилена. Поэтому вещество нуждается в особых безопасных способах хранения (ацетилен является токсичным для человека).
Карбид циркония
Основное соединение — ZrC. Стандартное состояние — небольшие кристаллы серого цвета, обладающие металлическим блеском. Температура плавления — 3530 градусов, однако при нагреве до 1200 градусов вещество начинает активно вступать в реакцию с атмосферным кислородом, что приводит к образованию оксидов. Вещество слабо реагирует с кислотами, щелочами и солями, однако может вступать в реакцию с атомизированным азотом в составе сложных веществ, что приводит к образованию нитритов. Поэтому вещество нуждается в особых способах хранения.