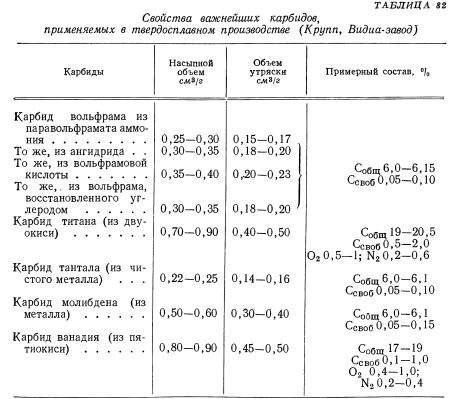
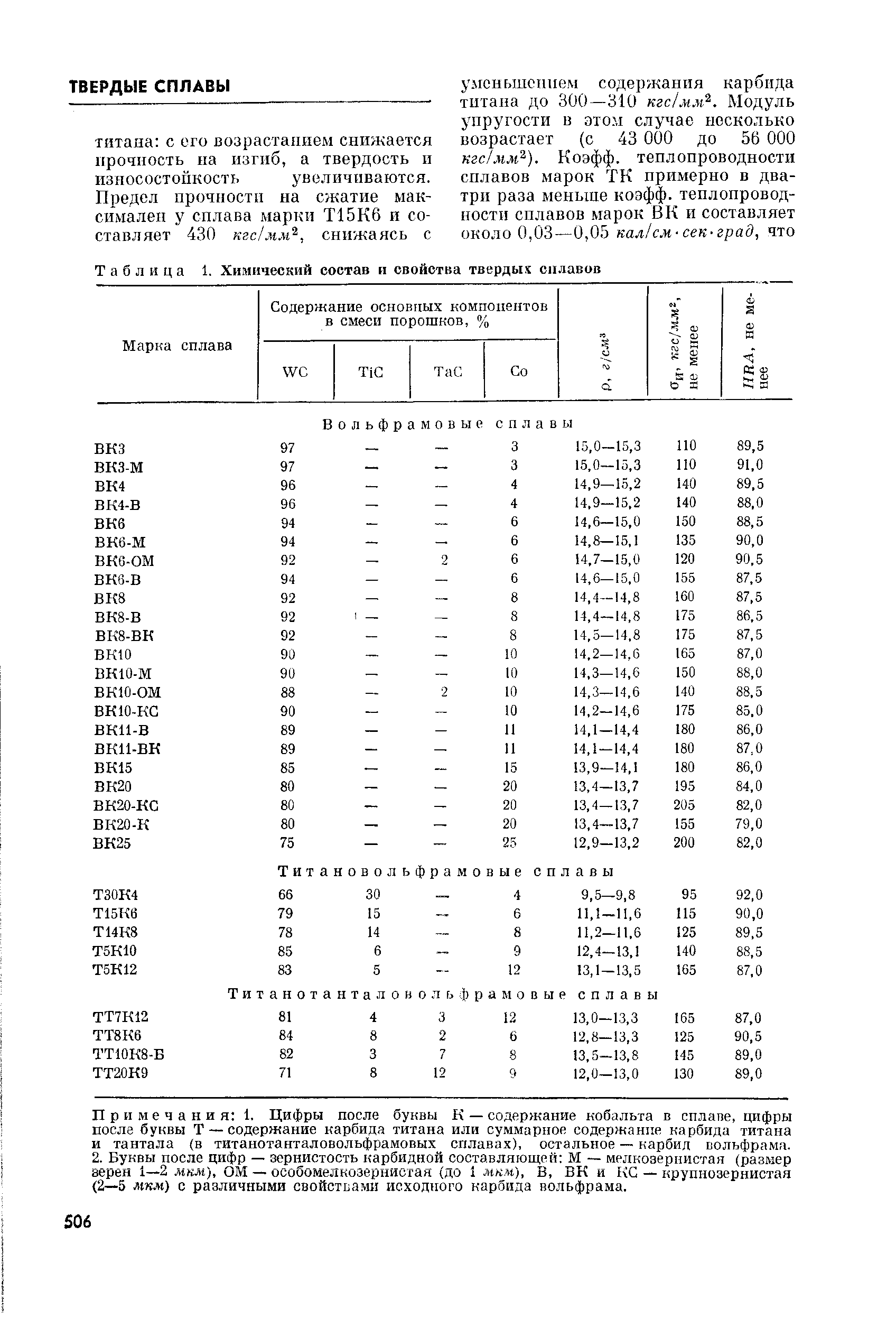
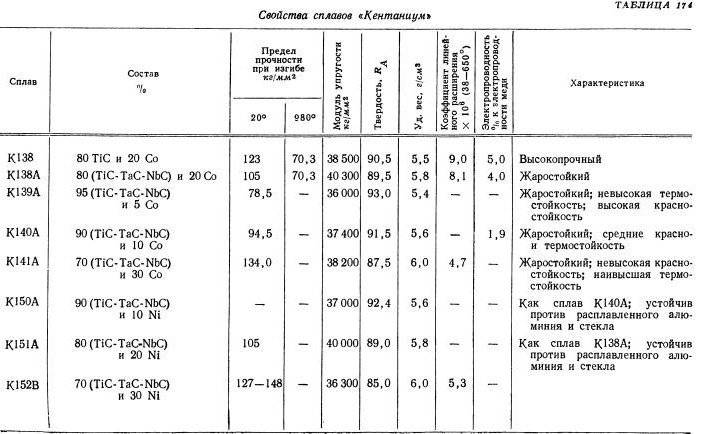
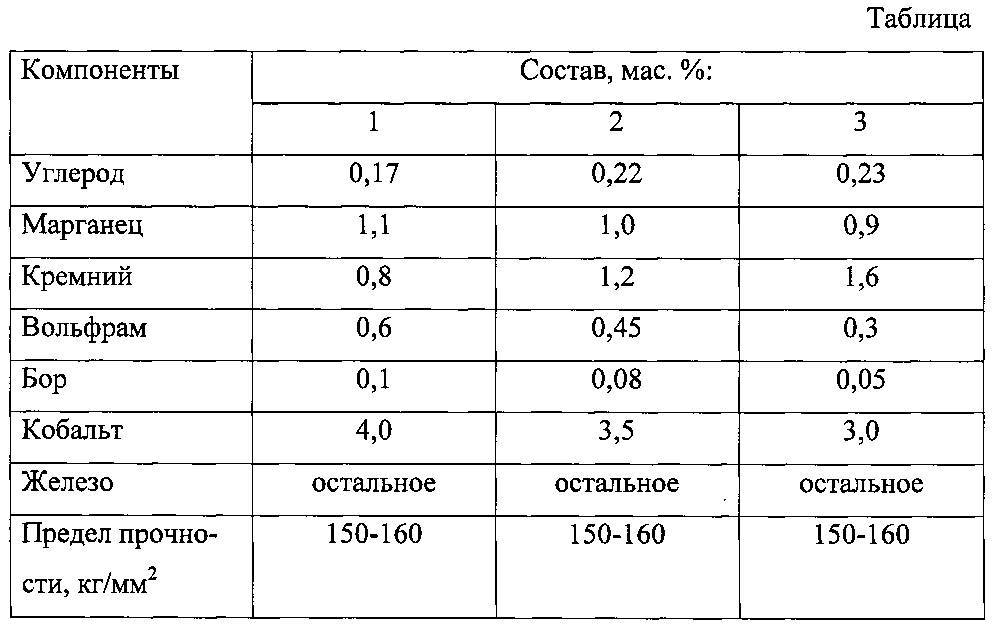
Свойства карбидов вольфрама
При высоких значениях температуры плавления, термостойкость карбидов вольфрама – достаточно низкая. Объясняется такое противоречие просто: кристаллическая структура и WC, и W2С – весьма жёсткая, поэтому термическое расширение практически отсутствует. С другой стороны карбид вольфрама обладает значительной теплопроводностью, причём для WC этот параметр с повышением температуры возрастает вдвое интенсивнее, чем у W2С.
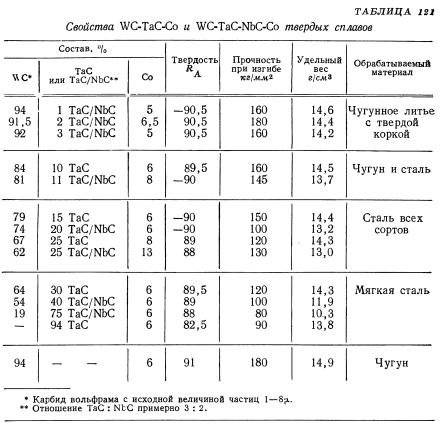
Оптимальным диапазоном температур эксплуатации деталей, изготовленных из карбидов вольфрама, считается 200…3000С. С увеличением процентного содержания кобальта в твёрдых сплавах (до 20…25%) допустимые температуры эксплуатации возрастают до 700…8000С, превышая температуростойкость всех известных марок сталей (за исключением жаропрочных).
Карбиды вольфрама – соединения с хорошей электропроводностью, причём для WC этот показатель выше, чем у W2C, практически в 4 раза. Удельное электросопротивление карбидов вольфрама растёт при повышении температуры. Пропорционально этому, кстати, падают показатели упругости. Именно поэтому карбиды вольфрама хорошо обрабатываются электрофизическими методами: локальное введение высококонцентрированного источника тепла (дуга, искра, электрический импульс) повышает температуру в зоне обработки и способствует размерному разрушению структуры рассматриваемых соединений.
 С точки зрения практического применения для карбидов вольфрама большее значение имеют их механические показатели – твёрдость и хрупкость. Получаемая в итоге микротвёрдость зависит в основном от температуры, при которой в вольфрамовом порошке формируются карбиды (менее — от степени их пористости). При повышении температуры дефекты в зёрнах залечиваются, поскольку возрастает подвижность атомов вольфрама и углерода. Поэтому конечная микротвёрдость соединений возрастает. При этом анизотропия свойств выражается значительно меньше, чем аналогичный показатель для металлов. Это упрощает предварительное ориентирование заготовки перед её обработкой.
С точки зрения практического применения для карбидов вольфрама большее значение имеют их механические показатели – твёрдость и хрупкость. Получаемая в итоге микротвёрдость зависит в основном от температуры, при которой в вольфрамовом порошке формируются карбиды (менее — от степени их пористости). При повышении температуры дефекты в зёрнах залечиваются, поскольку возрастает подвижность атомов вольфрама и углерода. Поэтому конечная микротвёрдость соединений возрастает. При этом анизотропия свойств выражается значительно меньше, чем аналогичный показатель для металлов. Это упрощает предварительное ориентирование заготовки перед её обработкой.
Упругость карбидов вольфрама – максимальная для своего класса соединений тугоплавких металлов с углеродом, причём она возрастает с увеличением пористости
Это обстоятельство важно для изделий (в химсоставе которых присутствуют карбиды вольфрама), работающих в условиях знакопеременных нагрузок
Пластичность карбидов вольфрама крайне низка, и не превышает 0,015%.
Структура
Структура α-WC, атомы углерода серые. Существуют две формы WC: гексагональная форма α-WC ( hP2 , пространственная группа P 6 м2, № 187) и кубическая высокотемпературная форма β-WC, имеющая структуру каменной соли . Гексагональную форму можно представить себе как состоящую из простой гексагональной решетки атомов металла слоев, лежащих непосредственно друг над другом (т. Е. Не плотно упакованных), с атомами углерода, заполняющими половину пустот, придающих как вольфраму, так и углероду правильную тригонально-призматическую 6 координацию. . Из размеров элементарной ячейки можно определить следующие длины связей: расстояние между атомами вольфрама в гексагонально упакованном слое составляет 291 мкм, кратчайшее расстояние между атомами вольфрама в соседних слоях составляет 284 мкм, а длина углеродной связи вольфрама составляет 220 мкм. . Таким образом, длина связи вольфрам-углерод сравнима с одинарной связью в W ( CH 3 ) 6 (218 пм), в котором сильно искажена тригонально-призматическая координация вольфрама.
Молекулярный WC был исследован, и эта газовая фаза имеет длину связи 171 пм для 184 W 12 C .
Получение
Карбид вольфрама можно получить одним из следующих способов.
Непосредственным насыщением вольфрама углеродом:
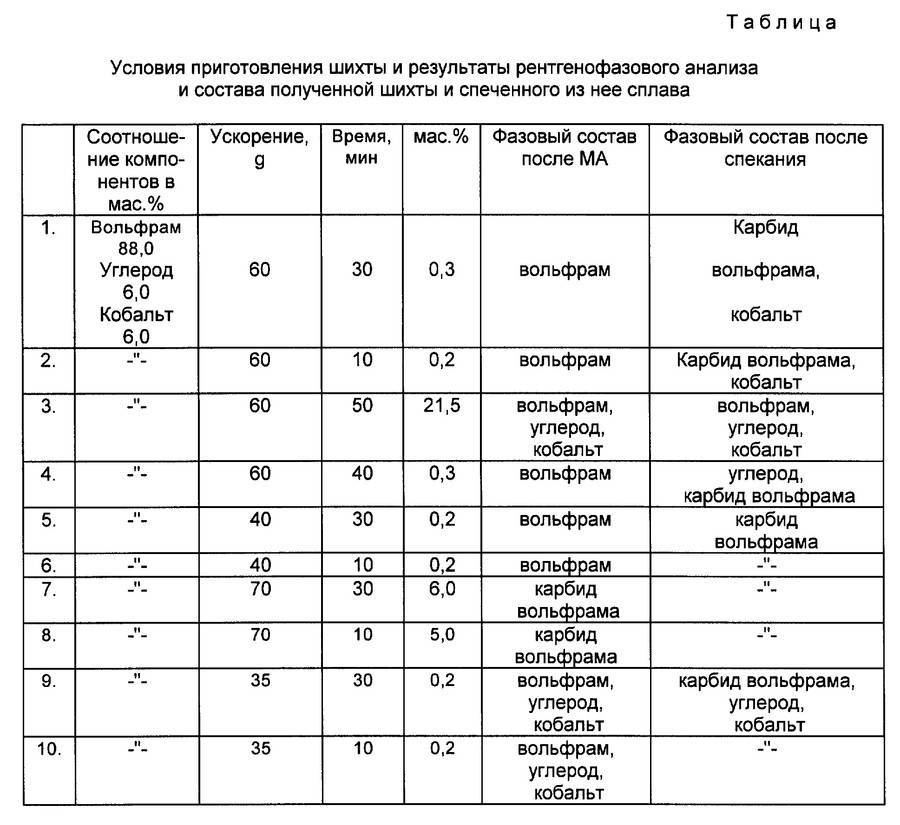
В основе процесса получения карбида вольфрама лежит реакция: W + C = W C {\displaystyle {\mathsf {W+C=WC}}} Образование WC происходит с образованием на поверхности частиц вольфрама монокарбида вольфрама, из которого внутрь частицы диффундирует углерод и образует ниже лежащий слой составом W2C. При получении WC используют порошок вольфрама, восстановленный из его оксида, и сажу. Взятые в необходимом количестве порошки смешивают затем брикетируют или насыпают с утрамбовкой в графитовые контейнеры и помещают в печь. Для защиты порошка от окисления процесс синтеза ведут в среде водорода, который взаимодействуя с углеродом при температуре от 1300 °C образует ацетилен. Образование карбида вольфрама идет в основном через газовую фазу за счет углерода содержащегося в газах. Реакции карбидизации имеют следующий вид: 2 C + H 2 = C 2 H 2 {\displaystyle {\mathsf {2C+H_{2}=C_{2}H_{2}}}} 2 W + C 2 H 2 = 2 W C + H 2 {\displaystyle {\mathsf {2W+C_{2}H_{2}=2WC+H_{2}}}} При наличии в среде окиси углерода процесс идет по реакции: C + C O 2 = 2 C O {\displaystyle {\mathsf {C+CO_{2}=2CO}}} 2 C O + W = W C + C O 2 {\displaystyle {\mathsf {2CO+W=WC+CO_{2}}}} Обычно процесс получения карбида вольфрама ведут при температуре 1300−1350 °C для мелкозернистых порошков вольфрама и 1600 °C для крупнозернистых, а время выдержки составляет от 1 до 2 часов. Полученные слегка спёкшиеся блоки карбида вольфрама измельчают и просеивают через сита.
Восстановлением оксида вольфрама углеродом с последующей карбидизацией:
Этот метод в отличие от выше описанного совмещает процесс восстановления и карбидизации вольфрама, при этом в шихту добавляют недостающее количество сажи для образования карбида. Восстановление оксида вольфрама WO3 происходит через газовую фазу в среде CO и водорода.
Восстановлением соединений вольфрама с последующей карбидизацией:
Еще одним способом получения карбида вольфрама является нагрев смеси вольфрамовой кислоты, вольфрамового ангидрида (WO3) или паравольфрамата аммония ((NH4)10••x H2O) в среде водорода и метана при температуре 850−1000 °C.
Осаждением из газовой фазы:
Получение карбида вольфрама из газовой фазы основано на разложении карбонила вольфрама при температуре 1000 °C.
Электролизом расплавленных солей:
Электролиз смеси расплавленных бората натрия, карбоната натрия, фторида лития и вольфрамового ангидрида позволяет получить карбид вольфрама.
Монокристаллы карбида вольфрама:
Монокристаллы WC могут быть получены выращиванием из расплава. Для этого смесь составом Co−40%WC плавят в тигле из оксида алюминия при температуре 1600 °C и после гомогенизации расплава температуру снижают до 1500 °C со скоростью 1−3 °C/мин. и выдерживают при этой температуре в течение 12 часов. После чего образец охлаждают и растворяют кобальтовую матрицу в кипящей соляной кислоте. Также может быть использован метод Чохральского для выращивания больших монокристаллов (до 1 см).
Химические свойства
Существует два хорошо охарактеризованных соединения вольфрама и углерода, WC и полукарбид вольфрама
, W 2 C . Оба соединения могут присутствовать в покрытиях, и пропорции могут зависеть от метода покрытия.
Еще одно метастабильное соединение вольфрама и углерода может быть создано путем нагревания фазы WC до высоких температур с помощью плазмы, а затем закалки в инертном газе (плазменная сфероидизация).
Этот процесс вызывает сфероидизацию макрокристаллических частиц WC и приводит к образованию нестеициометрической высокотемпературной фазы WC. 1-х существует в метастабильной форме при комнатной температуре. Тонкая микроструктура этой фазы обеспечивает высокую твердость (2800-3500 HV) в сочетании с хорошей ударной вязкостью по сравнению с другими соединениями карбида вольфрама. Мета-стабильная природа этого соединения приводит к снижению высокотемпературной стабильности.
При высоких температурах WC разлагается на вольфрам и углерод, и это может происходить во время высокотемпературного термического напыления , например, в методах высокоскоростного кислородного топлива (HVOF) и высокоэнергетической плазмы (HEP).
Окисление WC начинается при 500–600 ° C (932–1112 ° F). Он устойчив к кислотам и подвергается воздействию только фтористоводородной кислоты / азотной кислоты (HF / HNO 3 ) смеси выше комнатной температуры. Он реагирует с газообразным фтором при комнатной температуре и хлором выше 400 ° C (752 ° F) и не реагирует с сушкой H 2 до температуры плавления. Мелкодисперсный WC легко окисляется в водных растворах перекиси водорода . При высоких температурах и давлениях он вступает в реакцию с водным раствором карбоната натрия с образованием вольфрамата натрия. Эта процедура используется для извлечения металлолома из цементированного карбида из-за его селективности.
Карбиды ниобия Nb2C и NbC
В таблице даны физические свойства карбидов ниобия Nb2C и NbC. Плотный карбид ниобия NbC имеет серовато-коричневый или бледно-лиловый металлический цвет. Порошок NbC имеет фиолетовый оттенок.
Карбиды ниобия при комнатной температуре химически инертны, обладают высокой химической стойкостью к действию кислот и их смесей даже в нагретом состоянии. Однако, они растворимы в смеси плавиковой и азотной кислоты.
При нагревании на воздухе NbC слегка обезуглероживается. До температуры 2500°С он устойчив в атмосфере азота. Температура активного окисления карбида ниобия составляет 900…1000°С. Область температурной устойчивости — до 3890°С. Он стоек в расплавах металлов (Cu, Al), имеет высокую твердость по шкале Мооса.
| Свойства/карбид | Nb2C | NbC |
|---|---|---|
| Молекулярная масса | 197,8 | 105 |
| Тип решетки | Гексагональная | Кубическая |
| Плотность, кг/м3 | 7860 | 7560 |
| Температура плавления, °С | 2927 | 3480 |
| Температура кипения, °С | — | 4500 |
| Твердость по шкале Мооса | — | 9-10 |
| Средний ТКЛР в интервале 20-1100°С, α·106, град-1 | 6,5 | |
| Удельная массовая теплоемкость при 20°С, Дж/(кг·град) | 315 | 355 |
| Молярная теплоемкость при 25°С, кДж/(кмоль·град) | 30,36 | 37,35 |
| Коэффициент теплопроводности при 20°С, Вт/(м·град) | — | 19 |
| Удельное электрическое сопротивление при 20°С, ρ·108, Ом·м | 55 | 46 |
- Чиркин В. С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967. — 474 с.
- Кржижановский Р. Е., Штерн З. Ю. Теплофизические свойства неметаллических материалов (карбиды). Справочник. Л.: Энергия, 1976. — 120 с.
Применение вольфрама
При помощи такого металла происходит активное создание нити накаливания, нагревателей, экраны вакуумных печей, рентгеновские трубки, которые нужны для использования в условиях повышенной температуры.

Сталь, легированная вольфрамом, обладает высокими качествами прочности. Готовая продукция из таких разновидностей сплавов применяется для создания инструментов широкого использования: бурение скважин, медицина, изделия для качественной обработки материалов в процессе машиностроения (особые режущие пластины). Главным достоинством таких соединений станет особая устойчивость к истиранию, небольшая вероятность развития трещин во время эксплуатации вещи. Самой известной в процессе строительства считается марка стали с применением вольфрама, которая имеет название победит.
Химическая промышленность также нашла в себе место для использования металла. Из него можно производить краски, пигменты и катализаторы.
Атомная промышленность применяет тигли из этого металла, а также специализированные контейнеры для хранения наиболее радиоактивных отходов.
О нанесении покрытия из элемента уже было указано выше. Оно используется для нанесения на такие материалы, которые работают при воздействии высоких температур в восстановительной, а также нейтральной среде, как специальная защитная плёнка.
А также есть такие прутки, которые применяются и в других сварках. Так как вольфрам неизменно продолжает оставаться самым тугоплавким металлом, то во время проведения сварочных работ он применяется со специальными присадочными проволоками.
Вольфрам в быту можно применять, главным образом, в электротехнической цели.
Именно его стоит использовать в качестве основного компонента (легирующий элемент) в процессе производства быстрорежущей стали. В среднем показатель содержания вольфрама варьируется от девяти до двадцати процентов. Кроме всего этого, он находится в составе инструментальной стали.
Такие разновидности стали используются во время производства свёрл, штампов, пуансонов и фрез. К примеру, быстрорежущие стали P6 M5 говорят о том, что сталь была легирована молибденом и кобальтом. Кроме этого, вольфрам включает в себя магнитные стали, которые стоит разделять на вольфрамокобальтовые и вольфрамовые разновидности.
Вещество в повседневной жизни в чистом виде почти невозможно встретить. Карбид вольфрама представлен в качестве соединения металла с углеродом. Соединение таких веществ отличается высокой твёрдостью, износостойкостью, а также тугоплавкостью. На базе карбида вольфрама можно создавать инструментальные, производительные твёрдые сплавы, которые имеют около 90 процентов вольфрама и около 10 процентов кобальта. Из твёрдых сплавов можно изготавливать режущие части как бугровых, так и режущих инструментов.
Главная область использования вольфрама — это сварка металлов. Из сварки можно создавать особые электроды, которые используют для другого типа сплавки. Получаемые электроды можно назвать неплавящимися.
Синтез
Карбид вольфрама получают реакцией металлического вольфрама и углерода при 1400–2000 ° C. Другие методы включают запатентованный процесс с более низкотемпературным псевдоожиженным слоем, который реагирует либо на металлический вольфрам, либо на голубой WO. 3 с CO / CO 2 смесь и H 2 от 900 до 1200 ° C.
Унитаз также можно производить путем обогрева WO. 3 с графитом: непосредственно при 900 ° C или в водороде при 670 ° C с последующей науглероживанием в аргоне при 1000 ° C. Методы химического осаждения из паровой фазы , которые были исследованы, включают:
взаимодействие гексахлорида вольфрама с водородом (в качестве восстановителя ) и метаном (в качестве источника углерода) при 670 ° C (1238 ° F)
WCl 6 + H 2 + CH 4 → WC + 6 HCl
взаимодействие гексафторида вольфрама с водородом (в качестве восстановителя) и метанолом (в качестве источника углерода) при 350 ° C (662 ° F)
WF 6 + 2 часа 2 + CH 3 ОН → WC + 6 HF + H 2 O
Получение
Карбид вольфрама можно получить одним из следующих способов.
- Непосредственным насыщением вольфрама углеродом
В основе процесса получения карбида вольфрама лежит прямая реакция:
- \displaystyle{ \mathsf{W + C \rightarrow WC} }
Образование WC происходит с образованием на поверхности частиц вольфрама монокарбида вольфрама, из которого внутрь частицы диффундирует углерод и образует ниже лежащий слой состава W2C.
При получении WC используют порошок вольфрама, восстановленный из его оксида, и сажу. Взятые в необходимом соотношении порошкообразные вещества смешивают, брикетируют или насыпают с утрамбовкой в графитовые контейнеры и помещают в печь. Для защиты порошка от окисления процесс синтеза ведут в среде водорода, который, взаимодействуя с углеродом при температуре от 1300 °C, образует ацетилен. Образование карбида вольфрама идёт в основном через газовую фазу за счёт углерода, содержащегося в газах. Протекают следующие реакции карбидизации:
- \displaystyle{ \mathsf{2C + H_2 \rightarrow C_2H_2} }
- \displaystyle{ \mathsf{2W + C_2H_2 \rightarrow 2WC + H_2} }
При наличии в среде оксида углерода процесс идёт по реакции
- \displaystyle{ \mathsf{C + CO_2 \rightarrow 2CO} }
- \displaystyle{ \mathsf{2CO + W \rightarrow WC + CO_2} }
Обычно процесс получения карбида вольфрама ведут при температуре 1300−1350 °C для мелкозернистых порошков вольфрама и 1600 °C для крупнозернистых, а время выдержки составляет от 1 до 2 часов. Полученные слегка спёкшиеся блоки карбида вольфрама измельчают и просеивают через сита.
- Восстановлением оксида вольфрама углеродом с последующей карбидизацией
- Этот метод в отличие от вышеописанного совмещает процесс восстановления и карбидизации вольфрама, при этом в шихту добавляют недостающее количество сажи для образования карбида. Восстановление оксида вольфрама WO3 происходит через газовую фазу в среде CO и водорода.
- Восстановлением соединений вольфрама с последующей карбидизацией
- Ещё одним способом получения карбида вольфрама является нагрев смеси вольфрамовой кислоты, вольфрамового ангидрида (WO3) или паравольфрамата аммония ((NH4)10·[H2W12O42]·xH2O) в среде водорода и метана при температуре 850−1000 °C.
- Осаждением из газовой фазы
- Получение карбида вольфрама из газовой фазы основано на разложении карбонила вольфрама при температуре 1000 °C.
- Электролизом расплавленных солей
- Электролиз смеси расплавленных бората натрия, карбоната натрия, фторида лития и вольфрамового ангидрида позволяет получить карбид вольфрама.
- Монокристаллы карбида вольфрама
- Монокристаллы WC могут быть получены выращиванием из расплава. Для этого смесь составом Co−40 %WC плавят в тигле из оксида алюминия при температуре 1600 °C и после гомогенизации расплава температуру снижают до 1500 °C со скоростью 1−3 °C/мин и выдерживают при этой температуре в течение 12 часов. После чего образец охлаждают и растворяют кобальтовую матрицу в кипящей соляной кислоте. Также может быть использован метод Чохральского для выращивания больших монокристаллов (до 1 см).
Сплавы
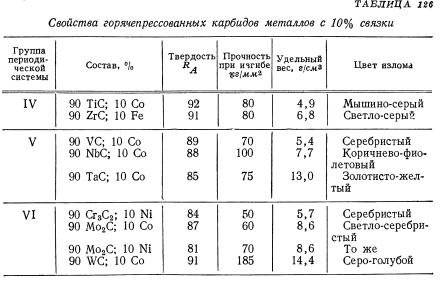
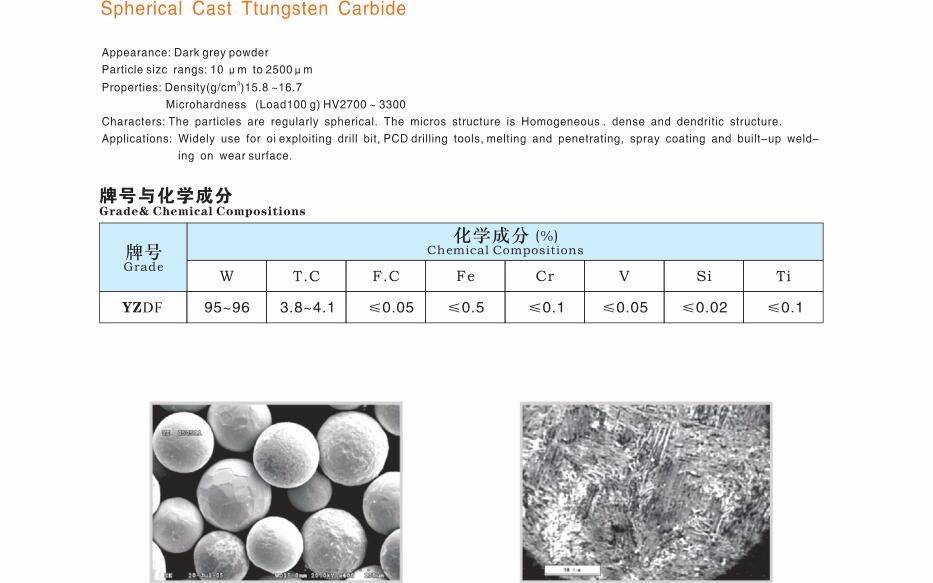
Ввиду плохой обрабатываемости карбид вольфрама применяют не в чистом виде, а создают сплавы с ним. Наиболее распространены твердые варианты с кобальтом. Также встречаются более сложные сплавы, включающие карбид тантала и титана. При этом вольфрам в любом случае преобладает, составляя 70 — 98%. Ввиду высокой температуры плавления при создании сплавов рассматриваемого материала не используют такие технологии, как легирование, плавление и смешение, так как они нерентабельны. Вместо этого применяется порошковая металлургия. Принцип данного метода состоит в использовании порошков основного металла и примеси. При этом они значительно отличаются температурой плавления. Их смешивают барабанно-шаровой мельницей и прессуют в близкую к целевой форму. Ей придают монолитность путем спекания при температуре, меньшей точки плавления основного металла. Далее приведена последовательность выполнения. Порошок карбида вольфрама измельчают до гранул целевого размера, предварительно увлажнив. Данный параметр определяется назначением материала, так как обуславливает конечные параметры изделий. Далее порошок смешивают со связующим веществом, представленным, например, кобальтом либо прочими металлами, и восковой мягкой смазкой, служащей для скрепления гранул после брикетирования. После этого порошок сушат в распылительной или вакуумной сушилке, удаляя большую часть влаги. С целью улучшения текучести полученных гранул производят пеллетизацию, придавая им шарообразную форму.
Существует несколько технологий придания порошку формы. Наиболее распространены среди них литье под давлением и прессование. Новейшим методом является 3D-печать. В завершении формирования частицы скреплены связующим восковым веществом. Далее форму подвергают нагреву. В результате удаляется восковый загуститель, а гранулы тугоплавкого металла скрепляются частицами расплавленного связующего металла после охлаждения. В рассматриваемом случае тугоплавким металлом является карбид вольфрама. Параметры конечного материала определяются долей связующего вещества: чем его больше, тем выше износостойкость и прочность, чем меньше – тем больше твердость и хрупкость. По завершении спекания предмет подвергают конечной обработке в виде шлифовки и т. д. К тому же на изделия из карбида вольфрама нередко наносят дополнительное защитное покрытие.
Вольфрамокобальтовые сплавы характеризуются минимальным напряжением на срез, значительной зависимостью параметров от доли кобальта, плохой обрабатываемостью. Первая особенность обуславливает неуместность таких материалов для применения в условиях сдвиговых деформаций. Из-за плохой подверженности обработке перед использованием заготовки из них пластифицируют либо спекают. Наличие кобальта повышает эксплуатационные температуры карбидов вольфрама до 700 — 800°С. По данному параметру они превосходят все марки сталей, кроме жаропрочных. Следует отметить, что, в отличие от чистого карбида вольфрама, его соединения в некоторых соотношениях с кобальтом токсичны.
Физические свойства
Карбид вольфрама представляет собой порошок серого цвета. Имеет две кристаллографические модификации: α-WC с гексагональной решёткой (периоды решетки a = 0,2906 нм, c = 0,2839 нм), пространственная группа P6m2 и β-WC с кубической гранецентрированной решеткой (a = 0,4220 нм), пространственная группа Fm3m, которая устойчива свыше 2525 °C. При этом в интервале температур 2525−2755 °C существуют обе фазы. Фаза α-WC не имеет области гомогенности, поэтому отклонение от стехиометрического состава приводит к появлению W2C или графита. При нагреве выше 2755 °C α-WC разлагается, образуя углерод и фазу β-WC. Фаза β-WC описывается формулой β-WC1−x, где (0 ⩽ x ⩽ 0,41) и имеет широкую область гомогенности, которая с понижением температуры уменьшается.
Обычно карбид вольфрама считается хрупким соединением, однако обнаружено, что под нагрузкой он проявляет пластические свойства, которые проявляются в виде полос скольжения.
Кристаллы карбида вольфрама имеют анизотропию твёрдости в различных кристаллографических плоскостях. В зависимости от ориентации минимальное значение микротвёрдости составляет 13 ГПа, а максимальное — 22 ГПа.
- Твёрдость по Роквеллу 92−94 HRA
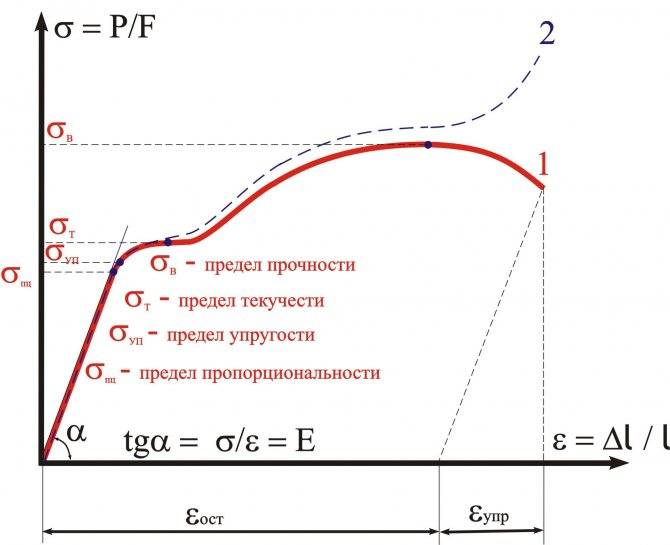
- Модуль упругости 710 ГПа
- Стандартная энтропия 8,5 ± 1,5 кал/(моль·°C)
- Энтропия образования из элементов −0,31 кал/(моль·°C)
- Коэффициент линейного теплового расширения 3,84−3,9·10−6 1/K
- Характеристическая температура (температура Дебая) 493 K
- Удельное электрическое сопротивление 19,2 ± 0,3 мкОм·см при 20 °C
- Удельная электропроводность 52200 Ом−1·см−1
- Термический коэффициент электросопротивления +0,495·10−3 1/K при 20−1500 °C
- Коэффициент термо-ЭДС −23,3 мкВ/K
- Работа выхода 3,6 эВ
- Постоянная Ричардсона 2,7 А/(см2·K2)
- Постоянная Холла (−21,8 ± 0,3)·104 см3/Kл
- Коэффициент электронной теплоёмкости 0,79 мДж/(моль·K2)
Характеристики ножей из карбида вольфрама
Впервые ножи из карбида вольфрама появились в Италии в 2017 году. Полученный сплав позволил получить ножи с прочностью 71 HRC.
Внешние характеристики следующие:
- Форма в виде ягнячьего копыта — прямое лезвие с закруглённым концом.
- Дополнен длинным обухом, который позволит удобно расположить палец и руку при сильном нажатии.
- Литая рукоятка изготовлена с помощью трёхмерной печати из стекловолокна.
- Рукоятка имеет прямые скосы, которые делают удобным расположение пальцев.
При производстве итальянские мастера используют нанотехнологии для скрепления рукоятки и лезвия. Сохраняет остроту лезвий в 20 раз дольше, чем обычные ножи.
 Кромочная пила из карбида.
Кромочная пила из карбида.
Кроме этого, этот материал используется для производства металлообрабатывающих инструментов, ювелирных изделий или для покрытия наручных часов.
Часто, из карбида вольфрама делают обручальные кольца, которые станут символом прочных семейных уз. Такие кольца переживут любой удар или другое внешнее воздействие.
Решения для всех отраслей промышленности
Технологии Wolfram широко используются многими компаниями для форсирования инновационных процессов, легкого и удобного доступа к данным и их анализа, а также решения сложных и неординарных научных и технических проблем. Наши продукты и услуги предлагают интуитивно понятные и мощные инструменты для разработки алгоритмов, числовых и символьных вычислений, анализа данных, вычислительной геометрии, генерирования отчетов, машинного обучения, обработки изображений, симуляции и моделирования сложных систем, и многого другого.
Промышленные и НИОКР разработки
Аэрокосмическая и оборонная промышленность » Электротехника » Машиностроение »

Биотехнология и медицина
Биоинформатика » Медицинская визуализация » Биологические науки »

Производство энергии
Науки об окружающей среде » Геология » Нефтедобывающая промышленность »

Финансовые услуги
Финансовый инжиниринг и финансовая математика » Управление финансовыми рисками » Актуарное дело »

Разработка программного обеспечения
Разработка интерфейсов » Разработка программного обеспечения » Веб-разработка »

Наука о данных
Наука о данных » Статистика » Исследование операций »
Применение[ | ]
Главное применение вольфрама — как основа тугоплавких материалов в металлургии.
Металлический вольфрам
Нить накаливания
- Тугоплавкость вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также в кинескопах и других вакуумных трубках.
- Благодаря высокой плотности вольфрам является основой тяжёлых сплавов, которые используются для противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий, сердечников бронебойных пуль и сверхскоростных роторов гироскопов для стабилизации полёта баллистических ракет (до 180 тыс. об/мин).
- Вольфрам используют в качестве электродов для аргонно-дуговой сварки.
- Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей.
- Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
- Высокая плотность вольфрама делает его удобным для защиты от ионизирующего излучения. Несмотря на бо́льшую плотность по сравнению с традиционным и более дешёвым свинцом, защита из вольфрама оказывается менее тяжёлой при равных защитных свойствах или более эффективной при равном весе. Из-за тугоплавкости и твёрдости вольфрама, затрудняющих его обработку, в таких случаях используются более пластичные сплавы вольфрама с добавлением никеля, железа, меди и др. либо взвесь порошкообразного вольфрама (или его соединений) в полимерной основе.
Соединения вольфрама
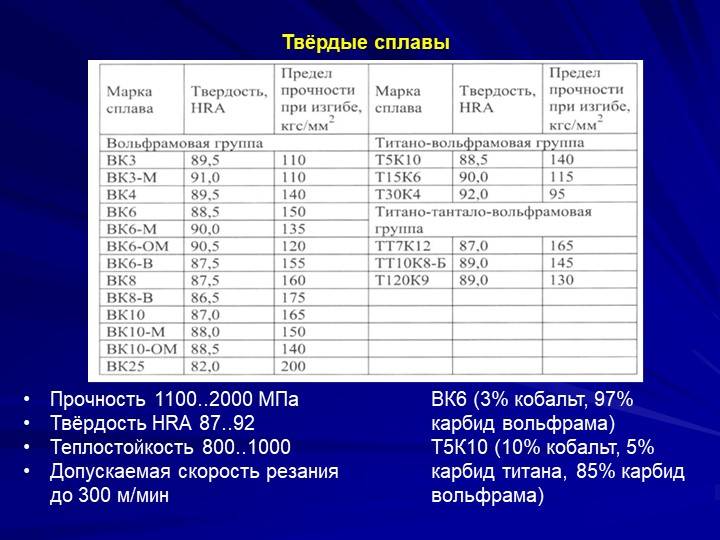
- Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам.
- Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка.
- Некоторые соединения вольфрама применяются как катализаторы и пигменты.
- Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
- Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К).
Другие сферы применения
Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Рынок вольфрама
Цены на металлический вольфрам (содержание элемента порядка 99 %) на конец 2010 года составляли около 40—42 долларов США за килограмм, в мае 2011 года составляли около 53—55 долларов США за килограмм. Полуфабрикаты от 58 USD (прутки) до 168 (тонкая полоса). В 2014 году цены на вольфрам колебались в диапазоне от 55 до 57 USD.
Именование
Исторически сложилось так называют Вольфрам, Wolf Rahm , вольфрамитового руды , открытой Питер Вулф был потом цементации и сцементированных связующее создание композиционного материала теперь называется «цементированный карбид вольфрама». Вольфрам Швеции «тяжелый камень». Colloquially среди работников в различных отраслях промышленности (например, обработка и плотницкий ), карбид вольфрама часто называют просто карбидом , несмотря на неточность использования. Среди широкой публики, растущая популярность карбида вольфрама кольца также привела к потребителям призывающих материала вольфрама .