Применение
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 февраля 2020 года |
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений
Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов. Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом транспортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет. Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
https://youtube.com/watch?v=DqbvEhn5uJc
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы. При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе. Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к смерти.
Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и транспортных средствах — везде, где в замкнутом пространстве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Углекислый газ
Углекислый газ, двуокись или оксид углерода (IV) представляет собой газообразное бесцветное вещество, не имеющее запаха. Его химическая формула — CO2. Двуокись не горит и в минимальных концентрациях не представляет опасности для организма. Также она является необходимым элементом для нормальной жизнедеятельности растений.
Это соединение кислорода и углерода примерно в полтора раза тяжелее воздуха. Оно плохо растворяется в воде, а при повышении давления или охлаждении оксид становится твёрдым. Твёрдая углекислота известна под названием «сухой лёд». Она отличается способностью переходить из твёрдого состояния в газообразное, минуя жидкое.
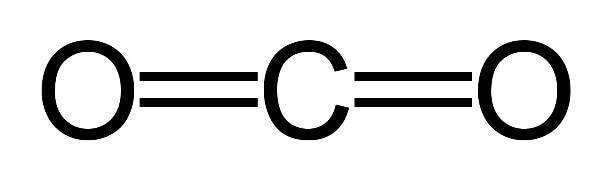
Атом углерода в этом соединении имеет пару двойных связей с кислородными атомами. Полярность четырёх связей делает молекулу двуокиси неполярной. Это хорошо видно в структурной формуле оксида, которая наглядно демонстрирует связь атомов внутри молекулы:
О=С=О.
Взаимодействие с другими веществами
В химии углекислота считается солеобразующим оксидом, проявляющим слабые свойства окислителя. Она прекрасно взаимодействует с водой, причём эта реакция является практически полностью обратимой.
Вещество имеет следующие химические свойства:
- Вступление в реакцию с основными оксидами и основаниями. Соединение взаимодействует лишь с щелочами и их оксидами. При этом могут образовываться кислые и средние соли. К примеру, гидроксид калия в таком случае образует гидрокарбонат калия, который является кислой солью. Если же щелочи много, то получится карбонат калия — средняя соль.
- Взаимодействие с карбонатами с последующим образованием гидрокарбонатов.
- Реакции с некоторыми восстановителями, например, с углеродом, магнием и пероксидом натрия.
Методы получения
Углекислый газ получают и в лабораториях, и в промышленности. В лабораторных условиях для его производства применяются следующие методы:
- Воздействие сильными кислотными веществами на карбонаты и гидрокарбонаты различных металлов.
- Углекислое соединение образуется, когда растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III).
- Разложение растворимых гидрокарбонатов и нерастворимых карбонатов при высоких температурах.
На производстве двуокись получают из печных газов, а также из продуктов разложения известняка и доломита. Для этого смесь веществ промывают раствором карбоната калия. Реагент поглощает углекислоту и становится гидрокарбонатом. Получившееся вещество нагревают, что приводит к его разложению и высвобождению оксида углерода. Затем газ закачивают в баллоны.
Применение углекислоты
Химические и физические характеристики соединения позволяют использовать его в самых разных областях. Так, вещество активно применяется в химической промышленности, металлургии и при производстве бумаги.
А также углекислота применяется в следующих сферах деятельности:
- сварка;
- сельское хозяйство;
- медицина;
- фармацевтика;
- приборы и оборудование;
- защита окружающей среды;
- пищевая промышленность;
- пневматическое оружие.
Очень востребован этот вид оксида углерода в системах пожаротушения. Им наполняют специальные огнетушители. Их принцип действия основан на том, что углекислота не горит и весит больше воздуха. За счёт этого вещество окутывает очаг возгорания и перекрывает для огня источник кислорода, которые необходим для поддержания процесса горения. В таких условия пламя довольно быстро гаснет.
Физиологическое действие
Углекислота — нетоксичное вещество. Но если в воздухе её становится слишком много, то все живые организмы, дышащие кислородом, могут испытывать приступы удушья, способные привести к смерти. По этой причине углекислому газу присвоен четвёртый класс опасности.
Если уровень находящегося в воздухе углеродного соединения составляет от 2 до 4%, то человек чувствует сонливость и слабость. Когда концентрация двуокиси достигает 7—10%, начинают появляться симптомы удушья, похожи на признаки высотной болезни:
- головная боль;
- головокружение;
- слуховые расстройства;
- потеря сознания.
Чем выше концентрация газа в атмосфере, тем длительнее проявляются симптомы. При очень высокой концентрации оксида человек или животное быстро погибает от удушья, которое вызывается гипоксией.
Само по себе вдыхание воздуха с высоким содержанием двуокиси неопасно, а потому не влечёт за собой длительных проблем со здоровьем. После того как пострадавший переносится в атмосферу с обычным уровнем углекислоты, его самочувствие приходит в норму.
Слайды и текст этой презентации
Григорий

Слайд 2I. Строение молекул углекислого газаМолекулы углекислого газа всегда состоят из
двух атомов кислорода и одного атома углерода. Получить молекулу углекислого
газа из иного числа атомов углерода и кислорода невозможно. В рамках теории гибридизации атомных орбиталей две σ-связи образованы sp-гибридными орбиталями атома углерода и 2р-орбиталями атома кислорода. Не участвующие в гибридизации р-орбитали углерода образуют с аналогичными орбиталями кислорода p-связи. Молекула неполярная.

Слайд 3II.Открытие углекислого газа.Углекислый газ был первым между всеми другими
газами противопоставлен воздуху под названием «дикий газ» алхимиком XVI века
Вант Гельмонтом.Открытием СО2 было положено начало новой отрасли химии – пневматохимии (химии газов).Шотландский химик Джозеф Блэк (1728–1799) в 1754 году установил, что известковый минерал мрамор (карбонат кальция) при нагревании разлагается с выделением газа и образует негашеную известь (оксид кальция): CaCO3CaO + CO2 Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция: CaO + CO2CaCO3Этот газ был идентичен открытому Ван Гельмонтом «дикому газу», но Блэк дал ему новое название – «связанный воздух» – так как этот газ можно было связать и вновь получить твердую субстанцию – карбонат кальция.Несколько лет спустя Кавендиш обнаружил еще два характерных физических свойства углекислого газа – его высокую плотность и значительную растворимость в воде.

Слайд 4III. Физические свойстваОксид углерода (IV) – углекислый газ, газ
без цвета и запаха, тяжелее воздуха, растворим в воде, при
сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда» . При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С) .

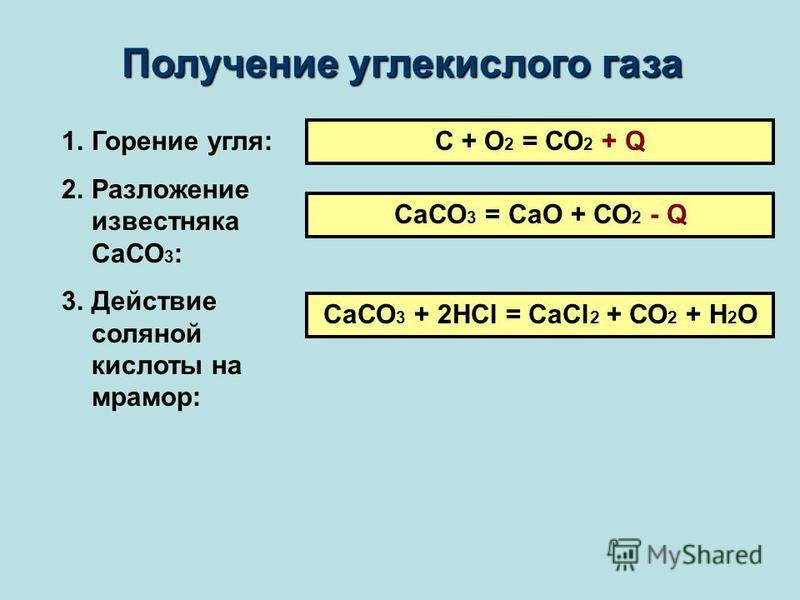
Слайд 5IV. Получение углекислого газа Получение углекислого
газа в промышленности:Оксид углерода 2 горит в кислороде и на
воздухе с выделением большого количества теплоты: 2СО+О2=2СО2 Таким же способом углекислый газ можно получать и в лаборатории.Оксид углерода 2 является сильным восстановителем, поэтому в промышленности его используют для восстановления железных руд: Fe2O3+3CO=2Fe+3CO2В промышленности оксид углерода 4 получают при сжигании угля или при прокаливании известняка: СаСО3=СаО+СО2 Получение углекислого газа в лаборатории:В лаборатории СО2 получают действием кислот на соли угольной кислоты Н2СО3: Na2CO3+H2SO4=Na2SO4+CO2+H2OПри действии кислот на карбонаты и их растворы происходит выделение диоксида углерода, вызывающего вспенивание раствора: СаСО3+НCl=CaCl2+CO2+H2O

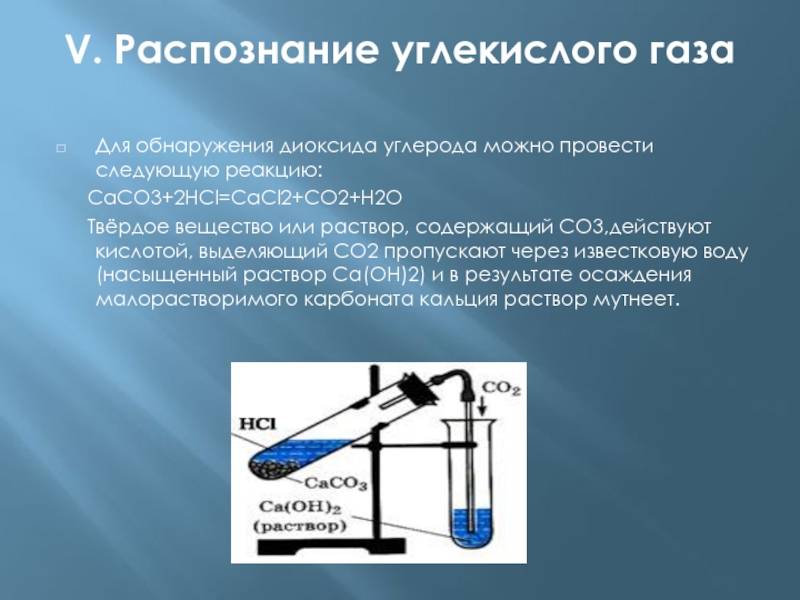
Слайд 6V. Распознание углекислого газаДля обнаружения диоксида углерода можно провести
следующую реакцию: СаСО3+2HCl=CaCl2+CO2+H2O Твёрдое вещество или
раствор, содержащий СО3,действуют кислотой, выделяющий СО2 пропускают через известковую воду (насыщенный раствор Са(ОН)2) и в результате осаждения малорастворимого карбоната кальция раствор мутнеет.
Слайд 7VI. Применение углекислого газаУглекислый газ применяют во многих отраслях.
Например: 1.Химическая отрасль; 2.Фармацевтика; 3.Пищевая
отрасль; 4.Медицина; 5.Металлургическая отрасль; 6.Лабораторные исследования и анализ; 7.Целлюлозно-бумажная отрасль; 8.Электроника; 9.Охрана окружающей среды.

Слайд 8 VII. Нахождение в природеСодержание углекислого газа в атмосфере
относительно небольшое, около 0,03% (по объему). Углекислый газ, сосредоточенный в
атмосфере, имеет массу 2200 биллионов тонн.В 60 раз больше углекислого газа содержится в растворенном виде в морях и океанах.В течение каждого года из атмосферы извлекается примерно 1/50 часть всего содержащегося в ней CO2 растительным покровом земного шара в процессе фотосинтеза, превращающего минеральные вещества в органические.Основная масса углекислого газа в природе образуется в результате различных процессов разложения органических веществ. Углекислый газ выделяется при дыхании растений, животных, микроорганизмов. Непрерывно увеличивается количество углекислого газа, выделяемого различными производствами. Углекислый газ содержится в составе вулканических газов, выделяется он и из земли в вулканических местностях.Вне земного шара оксид углерода (IV) обнаружен в атмосферах Марса и Венеры – планетах «земного типа».


Основные области применения СО 2 :
- в машиностроении и строительстве (для сварки и прочее);
- для холодной посадки частей машин;
- в процессах тонкой заточки;
- для электросварки, основанной на принципе защиты расплавленного металла от вредного воздействия атмосферного воздуха;
- в металлургии;
- продувка углекислым газом литейных форм;
- при производстве алюминия и других легкоокисляющихся металлов;
- в сельском хозяйстве для создания искусственного дождя;
- в экологии заменяет сильнодействующие минеральные кислоты для нейтрализации щелочной отбросной воды;
- в изготовлении противопожарных средств;
- применяется в углекислотных огнетушителях в качестве огнетушащего вещества, эффективно останавливает процесс горения;
- в парфюмерии при изготовлении духов;
- в горнодобывающей промышленности;
- при методе беспламенного взрыва горных пород;
- в пищевой промышленности;
- используется как консервант и обозначается на упаковке кодом Е290;
- в качестве разрыхлителя теста;
- для производства газированных напитков;
Получение в промышленности
Получение диоксида углерода в промышленности методологически разнообразно. Он находится в дымовых отходах, выпускаемых в атмосферу ТЭЦ и электростанциями, получается при брожении спирта и выступает как продукт реакции с природными карбонатами.
Индустрия получения двуокиси углерода широка. Газ можно абсорбировать несколькими способами из одного источника. Во всех случаях это поэтапный процесс очистки от примесей (для достижения требований ГОСТа) и достижения нужной консистенции, агрегатного состояния.
Получение газообразной двуокиси углерода
Газообразный CO2 извлекают из промышленных (нефтяных) дымов путем адсорбции моноэтаноламина (коммерчески выгодно) и карбонатом калия (редко). Принцип сбора частиц углерода одинаков для обоих веществ. Они направляются по трубопроводу к отходам и собирают в себя углекислый газ. После сбора, насыщенные углекислотой газы направляются на очистку.
В специальных емкостях происходит реакция в при повышенной температуре или заниженном давлении. В процессе высвобождается чистая углекислота и продукты распада (аммиак и другие).
Установка добычи углекислоты
Схематически процесс выглядит так:
- Отходящий дым смешивается с адсорбентами (газообразным карбонатом калия или моноэтаноламином);
- Накопившие в себе двуокись углерода газы поступают в специальный газгольдер для очистки;
- В реакции с высокой температурой или низким давлением происходит отделение углекислого газа от адсорбента.
В лаборатории извлечь много CO2 не получается. Но это возможно в реакции с гидрокарбонатами и кислотами. В отдельности CO2 можно выделить на промышленных станках для получения кислорода, аргона или азота. Углекислый газ здесь выступает как побочный продукт. Хранится он в специальных баллонах, поставляемых потребителю.
Получение жидкой углекислоты
Добыча жидкой углекислоты поэтапно связана с получением ее из газа. Из летучего газообразного состояния, при обработке водородом, раствором перманганата калия и углем, образуется жидкая двуокись.
Сжижение происходит из-за низкого давления, сопровождающего реакцию. После многоступенчатой очистки, жидкий диоксид углерода попадает в компрессор. Там он сжимается и подается для сушки в 2 адсорбера, поочередно перенимающие работу для восстановления. Параллельно сжатая жидкость очищается от запахов и переводится в конденсатор, а оттуда – на хранение.
Этот метод сжижения применяется для газов спиртового брожения. Он актуален для пропана, бутана и т.д. Его используют на крупных пивоварнях, а получаемая очищенная углекислота имеет высокие показатели качества.
Получение твердого диоксида углерода
Твердый диоксид образуют из жидкого путем обработки низкой температурой (-56°). В промышленных условиях только 20% переходят в твердое состояние, а остальные – испаряются.
Сухой лед
Порядок извлечения углекислотных кристаллов (сухого льда):
- Из емкости брожения газ переходит в емкость для промывки;
- В газгольдере после мытья он сжимается и сжижается;
- Многократно сжимаясь и нагреваясь, газообразный углерод охлаждается в специальных холодильниках;
- Жидкость очищается активированным углем;
- Поступает в холодильник, где охлаждается и дополнительно очищается от примесей;
- Охлажденный CO2 направляется на испарение и пресс, где комплектуется сухой лед.
Основное применение
CO2 широко применяется в промышленности и в быту – в огнетушителях и для изготовления газировки, для охлаждения продуктов и для создания инертной среды при сварке.

Основное применение углекислого газа
Применение углекислого газа отмечено в таких отраслях, как:
для чистки поверхностей сухим льдом.
Фармацевтика
- для химического синтеза компонентов лекарственных средств;
- создания инертной атмосферы;
- нормализация индекса pH отходов производства.

Углекислый газ в фармацевтике
Пищевая отрасль
- производство газированных напитков;
- упаковка продуктов питания в инертной атмосфере для продления срока годности;
- декаффеинизация кофейных зерен;
- замораживание или охлаждение продуктов.

Углекислый газ в пищевой отрасли
Медицина, анализы и экология
- Создание защитной атмосферы при полостных операциях.
- Включение в дыхательные смеси в качестве стимулятора дыхания.
- В хроматографических анализах.
- Поддержание уровня pH в жидких отходах производства.

Углекислый газ и экология
Электроника
- Охлаждение электронных компонентов и устройств при тестировании на температурную стойкость.
- Абразивная очистка в микроэлектронике (в твердой фазе).
- Очищающее средство в производстве кремниевых кристаллов.
Химическая отрасль
Широко применяется в химическом синтезе в качестве реагента и в качестве регулятора температур в реакторе. CO2 отлично подходит для обеззараживания жидких отходов с низким индексом pH.

Использование углекислого газа
Применяется также для осушения полимерных веществ, растительных или животных фиброматериалов, в целлюлозном производстве для нормализации уровня pH как компонентов основного процесса, так и его отходов.
Металлургическая отрасль
В металлургии CO2 в основном служит делу экологии, защиты природы от вредных выбросов путем их нейтрализации:

Применение углекислого газа в металлургии
- В черной металлургии — для нейтрализации плавильных газов и для донного перемешивания расплава.
- В цветной металлургии при производстве свинца, меди, никеля и цинка — для нейтрализации газов при транспортировке ковша с расплавом или горячих слитков.
- В качестве восстановительного агента при организации оборота кислотных шахтных вод.
Сварка в углекислой среде

Процесс сварки с применением углекислого газа
Разновидность сварки под флюсом является сварка в углекислой среде. Операции сварочных работ с углекислым газом осуществляется плавящимся электродом и распространен в процессе монтажных работ, устранении дефектов и исправления деталей с тонкими стенками.
Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции. Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O CO2 × H2O (растворение) Н2СО3
Диоксид углерода + вода угольная кислота
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
CH4 + 2O2 → CO2 + 2H2O + 891кДж
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3H2O + 2CO2 + Q
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Техника сварки в углекислом газе
Выполнение сварочных работ и технология полуавтоматической сварки в среде углекислого газа достаточно простая, по сути, от мастера требуется выдержать необходимый вылет проволоки и перемещать горелку автомата с одинаковой скоростью.
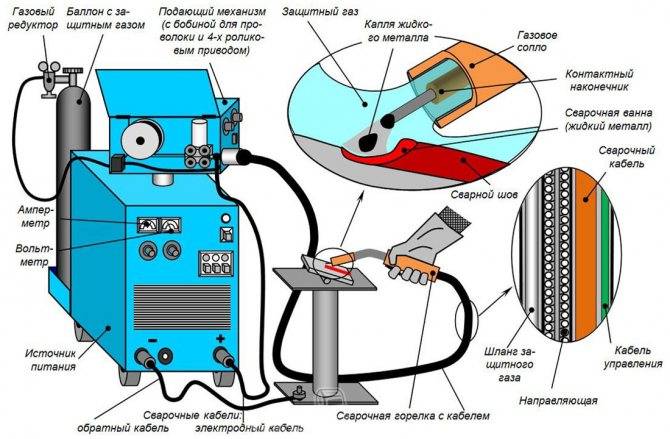
В результате получается равномерный шов без наплывов, обеспечивается достаточный провар стали и механическая прочность получаемого соединения.
Во время выполнения работ от мастера требуется соблюдение следующих рекомендаций:
- Перед началом сварки следует убедиться в том, что защитный газ выходит из горелки. Рабочее давление углекислоты при сварке полуавтоматом 0, 02 кПа. Но этот показатель не является абсолютным, наличие сквозняка, ветра, несколько увеличивает расход материала. Соответственно давление для создания нормального шва будет увеличиваться.
- Угол горелки должен находиться в пределах 65-75°. Шов необходимо вести справа налево, так лучше просматриваются свариваемые кромки.
- Сила тока. Режимы сварки в углекислом газе регулируются методом изменения скорости подачи проволоки и напряжения дуги.
Какое давление углекислоты при сварке
ГОСТ на полуавтоматическую сварку в углекислом газе регулируется руководящим документом 26-17-051-85. Согласно документу, стандартного баллона, наполненного СО², достаточно чтобы обеспечить 15-20 часов беспрерывной работы. Для увеличения производительности обязательно используют осушитель влаги.
Подача углекислоты может быть изменена в большую сторону при наличии сквозняков, ветра и других негативных факторов. Решающее значение при выборе подходящего рабочего режима играет качество получаемого шва.
Сущность сварки в среде углекислого газа сводится к тому, что СО² обеспечивает защиту обрабатываемой поверхности от перегрева. Как правило, качество шва напрямую зависит от расхода углекислоты при сварке полуавтоматом. При этом от мастера требуется обеспечить оптимальные затраты между использованием газа и расходом сварочной проволоки.
Расход углекислоты для сварочного полуавтомата
Хотя нормы расхода углекислоты зависят от многих факторов, в среднем для полуавтомата предусмотрены следующие затраты расходных материалов:
- Скорость подачи проволоки – зависит от ширины расходного материала, составляет, от 35-250 мм/сек.
- Расход газа – определяется качеством флюса и погодными условиями. Может варьироваться от 3 до 60 л/мин.
Расчет расхода углекислого газа при полуавтоматической сварке можно выполнить самостоятельно, зная следующие параметры:
- Затраты на подготовительные работы составляют около 10% от общего расхода СО².
- Удельный расход газа, необходимый для прохождения шва.
Также при расчетах принимают во внимание толщину проволоки и обрабатываемого металла

В баллон заливается около 25 кг углекислоты. В результате химической реакции из каждого килограмма получается около 509 л газа. Соответственно, одного стандартного баллона более чем достаточно для непрерывной работы в течение 12-15 часов.
Существует возможность обойтись без использования защитного газа. Вместо СО² применяют порошковую проволоку. При нагревании проволока, покрытая порошком, выделяет газ, который и защищает обрабатываемую поверхность от перегрева.
В комплект оборудования для полуавтоматической сварки в углекислом газе входит:
- Выпрямитель – может быть трансформаторного или инверторного типа. Первый оптимально подходит для толстой проволоки, второй обеспечивает равномерную подачу напряжения и стабильную дугу сварки.
- Подающий механизм – имеет ограничения по толщине проволоки. При выборе следует учитывать, что не каждый флюс можно будет использовать при выполнении сварочных работ.
- Держатель со шлангами.
Все оборудование в совокупности обеспечивает оптимальный рабочий режим и создается условия для формирования качественного сварного шва.
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Экономия смеси
Исходя из сказанного, можно сделать вывод, что расход регулируемой углекислотной среды зависит не только от прямых факторов — диаметра прутка, силы тока и толщины соединяемых металлических элементов. Косвенными факторами, влияющими на расход углексилоты являются погодные условия — ветер, открытая площадь.
Однако учитывая последние, имеется возможность минимизировать затраты сварочного процесса.
Оптимизированным вариантом послужит проведения работы в закрытом, искусственно проветриваемом помещении, с привлечением опытного сварщика. Новичку так же можно поручить процесс, однако расход все равно будет несколько или значительно больше. Неопытный сотрудник вправе предложить достичь экономии путем прикручивая вентиля на баллоне с углекислотой при полуавтоматической сварке.
Подобная операция уменьшит поток смеси к сварочной ванне, но увеличит приток кислорода из атмосферы, что скажется на снижении качества шва. Однако существует выход из этого положения.
Специалисты советуют использовать в работе многокомпонентные регулируемые газовые составы, которые позволяют уменьшить расход углекислоты с одновременным улучшением качества шва. Например, аргоновая смесь состоит из 20% двуокиси углерода и 80 — аргона. Ее главными преимуществами считаются:
- уменьшение количества использованной проволоки до 80%;
- сокращение количества прилипших брызг металла;
- увеличенная глубина провара элементов;
- меньшее число пор в сварном шве.
Общие же затраты на операцию снижаются до 20%.