Применение
Файл:Aluminum Metal.jpg
Кусок алюминия и американская монетка.
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевая фольга в пищевой промышленности и для упаковки.
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия сравнима с медью, при этом алюминий дешевле. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Правда, у алюминия как электротехнического материала есть неприятное свойство — из-за прочной оксидной плёнки его тяжело паять.
- Благодаря комплексу свойств широко распространён в тепловом оборудовании.
- В производстве строительных материалов как газообразующий агент.
- Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, например клапанам поршневых ДВС, лопаткам турбин, теплообменной аппаратуре, а также заменяют цинкование.
- Сульфид алюминия используется для производства сероводорода.
- Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
В качестве восстановителя
- Как компонент термита, смесей для алюмотермии
- Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов.
Сплавы на основе алюминия
В качестве конструкционного материала обычно используют не чистый алюминий, а разные сплавы на его основе.
- Алюминиево-магниевые сплавы обладают высокой коррозионной стойкостью и хорошо свариваются; из них делают, например, корпуса быстроходных судов.
- Алюминиево-марганцевые сплавы во многом аналогичны алюминиево-магниевым.
- Алюминиево-медные сплавы (в частности, дюралюминий) можно подвергать термообработке, что намного повышает их прочность. К сожалению, термообработанные материалы нельзя сваривать, поэтому детали самолётов до сих пор соединяют заклёпками.
- Алюминиево-кремниевые сплавы (силумины) лучше всего подходят для литья. Из них часто отливают корпуса разных механизмов.
- Комплексные сплавы на основе алюминия: авиаль.
- Алюминий переходит в сверхпроводящее состояние при температуре 1,2 Кельвина.
Алюминий как добавка в другие сплавы
Алюминий является важным компонентом многих сплавов. Например, в алюминиевых бронзах основные компоненты — медь и алюминий. В магниевых сплавах в качестве добавки чаще всего используется алюминий. Для изготовления спиралей в электронагревательных приборов используют (наряду с другими сплавами) фехраль (Fe, Cr, Al).
Ювелирные изделия
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Мода на них сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий и его соединения в ракетной технике
Алюминий и его соединения используются в качестве высокоэффективного ракетного горючего в двухкомпонентных ракетных топливах и в качестве горючего компонента в твердых ракетных топливах. Следующие соединения алюминия представляют наибольший практический интерес как ракетное горючее:
- Алюминий: горючее в ракетных топливах. Применяется в виде порошка и суспензий в углеводородах и др.
- Гидрид алюминия.
- Боранат алюминия.
- Триметилалюминий.
- Триэтилалюминий.
- Трипропилалюминий.
Теоретические характеристики топлив, образованных гидридом алюминия с различными окислителями.
| Окислитель | Удельная тяга(Р1,сек) | Температура сгорания °С | Плотность топлива г/см3 | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего % |
|---|---|---|---|---|---|
| Фтор | 348,4 сек | 5009°С | 1,504 | 5328 м/сек | 25% |
| Тетрафторгидразин | 327,4 сек | 4758°С | 1,193 | 4434 м/сек | 19% |
| ClF3 | 287,7 сек | 4402°С | 1,764 | 4762 м/сек | 20% |
| ClF5 | 303,7 сек | 4604°С | 1,691 | 4922 м/сек | 20% |
| Перхлорилфторид | 293,7 сек | 3788°С | 1,589 | 4617 м/сек | 47% |
| Окись фтора | 326,5 сек | 4067°С | 1,511 | 5004 м/сек | 38,5% |
| Кислород | 310,8 сек | 4028°С | 1,312 | 4428 м/сек | 56% |
| Перекись водорода | 318,4 сек | 3561°С | 1,466 | 4806 м/сек | 52% |
| N2O4 | 300,5 сек | 3906°С | 1,467 | 4537 м/сек | 47% |
| Азотная кислота | 301,3 сек | 3720°С | 1,496 | 4595 м/сек | 49% |
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl + 6Н+ = 2Аl3+ + 3H2;
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
Аl2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Al(OH)3 + NaOH = Na[Al(OH)4]
Химические свойства
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с O2, HNO3 (без нагревания), H2SO4(конц), но легко реагирует с HCl и H2SO4(разб). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель. Не допустить образования оксидной плёнки можно, добавляя к алюминию такие металлы, как галлий, индий или олово. При этом поверхность алюминия смачивают легкоплавкие эвтектики на основе этих металлов.
Легко реагирует с простыми веществами:
с кислородом, образуя оксид алюминия:
с галогенами при комнатной температуре (кроме фтора), образуя хлорид, бромид или иодид алюминия:
с другими неметаллами реагирует при нагревании:
Сульфид и карбид алюминия полностью гидролизуются:
Со сложными веществами:
с водой (после удаления защитной оксидной плёнки, например, амальгамированием или растворами горячей щёлочи):
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
Легко растворяется в соляной и разбавленной серной кислотах:
При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
восстанавливает металлы из их оксидов (алюминотермия):
Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.

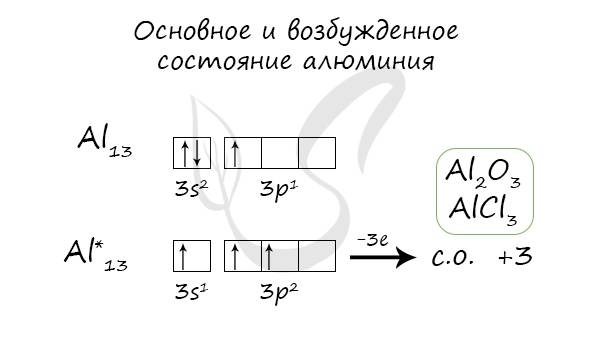
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Природные соединения

Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
Химические свойства
Реакции с неметаллами
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)

Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.
При прокаливании комплексные соли не образуются, так вода испаряется — вместо них образуются (в рамках ЕГЭ) средние соли — алюминаты (академически — сложные окиселы):
Реакция с водой
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.

Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.

Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)

Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)

Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алюминий на наших кухнях
Наряду с глобальными новостройками в нашей жизни еще немало мест, где алюминий занимает одну из ведущих ролей. И самую маленькую, но не менее важную площадь занимают наши кухни. Но если внимательно присмотреться, то серебристый металл захватил там, чуть ли не господствующее положение.
В нашем мире всегда полным-полно крайностей. Одни стремятся окружить себя только предметами роскоши. Другие стараются экономить везде, где это только можно. Так и на наших кухнях можно увидеть либо дорогую сталь с позолотой, либо дешевый пластик. И в основном это касается корпусов бытовой техники. Начиная от кофеварки и заканчивая холодильником.
Но в мире еще достаточно и людей, которые придерживаются золотой середины. И как не банально это звучит, они выбирают аппаратуру, заключенную в алюминиевый корпус. Ведь это самое разумное решение, которое может предложить производитель. Оно решает сразу несколько проблем.

Алюминиевый корпус кофемашиныИсточник tiu.ru
В плане надежности и прочности конструкции, алюминий может легко поспорить со сталью. Отсюда и высокая безопасность при эксплуатации, поскольку материал не ржавеет и не горит. А высокая его пластичность позволяет штамповать различные формы, которые легко впишутся в любой дизайн кухни. От современного до ретро или кантри.
Кстати. Очень модный хай-тек вообще невозможен без серебристых сооружений. А все из-за великолепного блеска алюминия. Но бывает, что даже матовая поверхность смотрится намного выигрышнее. Правда, это все дело вкуса.
А на втором месте после техники находится кухонная посуда. Но приоритеты могут быть другими. А чтобы развеять возражения скептиков, следует указать на один факт. Современная посуда из алюминия, это далеко не то, к чему привык бывший советский обыватель. Времена, когда на кухнях ели из матовых алюминиевых мисок, ковыряясь в них серыми (а не серебристыми) ложками или вилками, давно прошли.
Химические свойства
Алюминий — серебристо-белый легкий металл, технический состав плавится при температуре 658 градусов, чистый — при 660, а закипает он при 2518, 8. К физическим свойствам относится и пластичность. Она у вещества очень высокая: 35% и 50% у промышленного и природного сплава соответственно. Его можно раскатать до состояния фольги или тонкого листа.

Модуль Юнга у алюминия составляет 70 ГПа, коэффициент Пуассона — 0,34. Он отлично отражает свет, проводит тепло и электричество. Вещество может взаимодействовать практически со всеми металлами, образует сплавы с кремнием, магнием, медью.
В нормальных условиях алюминий покрыт прочной тонкой оксидной пленкой, поэтому на него не действуют обычные окислители. Но он реагирует на разбавленные серные растворы.
Но если пленка разрушилась — ее могут повредить соли аммония, горячие щелочи или амальгамирование, то вещество превращается в восстановитель. Галий, олово и индий не дают ей образоваться, при этом поверхность металла нужно покрыть легкоплавкими эвтектиками.
Перечень того, с чем реагирует алюминий:
- кислородом;
- галогенами;
- неметаллами;
- водой и ее парами;
- щелочами;
- соляной, азотной и серной кислотами.

При реакции с кислородом образуется оксид алюминия, его формула — 4Al + 3O2 = 2Al2O3. Фторид вещества: 2Al + 3F2 = 2AlF3. Сульфид образуется при взаимодействии с серой:2Al + 3S = Al2S3, 2Al + N2 = 2AlN — это нитрид металла, 4Al + 3C = Al4C3 — карбид после реакции с углеродом.
Характерная степень окисления алюминия — плюс три, но его атомы могут образовывать дополнительные связи. При взаимодействии со щелочами образуется тетрагидроксоалюминат (или другие алюминаты): 2Al + 2NaOH + 6H2O = 2Na (Al (OH)4) + 3H2. Металл можно растворить в разбавленной серной кислоте: 2Al + 3H2SO4 = Al2 (SO 4)3 + 3H2.
Интересна реакция алюминия с водой. Для нее необходимо удалить защитную пленку с помощью раствора горячей щелочи или амальгамы: 2Al + 6H2O = 2Al (OH3) + 3H2. При взаимодействии с окислителями происходит разложение вещества: 2Al + 6H2SO4 = Al2 (SO4)3 + 3SO2 + 6H2O — растворимые соли, уравнение реакций. Химические свойства алюминия включают восстановление металлов из оксидов, реакцию с парами воды.
Физические свойства
Алюминий не имеет каких-либо уникальных физических свойств, но их сочетание делает металл одним из самых широко востребованных. Твердость чистого алюминия по шкале Мооса равняется трем, что значительно ниже, чем у большинства металлов. Данный факт является практически единственным препятствием для использования чистого металла.
Если внимательно рассмотреть таблицу физических свойств алюминия, то можно выделить такие качества, как:
- Малую плотность (2.7 г/см3);
- Высокую пластичность;
- Низкое удельное электрическое сопротивление (0,027 Ом·мм2/м);
- Высокую теплопроводность (203.5 Вт/(м·К));
- Высокую светоотражательная способность;
- Низкую температуру плавления (660°С).
Такие физические свойства алюминия, как высокая пластичность, низкая температура плавления, отличные литейные качества, позволяют использовать данный металл в чистом виде и в составе сплавов на его основе для производства изделий любой самой сложной конфигурации. Вместе с этим, это один из немногих металлов, хрупкость которого не возрастает при охлаждении до сверхнизких температур. Данное свойство определило одну из областей применения в конструктивных элементах криогенной техники и аппаратуры.  Существенно более высокую прочность, сравнимую с прочностью некоторых сортов стали, имеют сплавы на основе алюминия. Наибольшее распространение получили сплавы с добавлением магния, меди и марганца – дюралюминиевые сплавы и с добавлением кремния – силумины. Первая группа отличается высокой прочностью, а последняя одними из самых лучших литейных качеств. Невысокая температура плавления снижает затраты на производство и себестоимость технологических процессов при производстве конструкционных материалов на основе алюминия и его сплавов. Для изготовления зеркал используется такое качество, как высокий коэффициент отражения, сравнимый с показателем серебра, легкость и технологичность вакуумного напыления алюминиевых пленок на различные несущие поверхности (пластики, металл, стекло).
Существенно более высокую прочность, сравнимую с прочностью некоторых сортов стали, имеют сплавы на основе алюминия. Наибольшее распространение получили сплавы с добавлением магния, меди и марганца – дюралюминиевые сплавы и с добавлением кремния – силумины. Первая группа отличается высокой прочностью, а последняя одними из самых лучших литейных качеств. Невысокая температура плавления снижает затраты на производство и себестоимость технологических процессов при производстве конструкционных материалов на основе алюминия и его сплавов. Для изготовления зеркал используется такое качество, как высокий коэффициент отражения, сравнимый с показателем серебра, легкость и технологичность вакуумного напыления алюминиевых пленок на различные несущие поверхности (пластики, металл, стекло).
При плавке алюминия и выполнения литья особое внимание обращается на способность расплава поглощать водород. Не оказывая действий на химическом уровне, водород способствует уменьшению плотности и прочности за счет образования микроскопических пор при застывании расплава
Благодаря низкой плотности и малому электрическому сопротивлению (ненамного выше меди), провода из чистого алюминия находят преимущественное применение при передаче электроэнергии в линиях электропередач, всего диапазона токов и напряжений в электротехнике, как альтернатива медным силовым и обмоточным проводам. Сопротивление меди несколько меньше, поэтому провода из алюминия необходимо использовать большего сечения, но итоговая масса изделия и его себестоимость оказываются в несколько раз меньше. Ограничением служит только несколько меньшая прочность алюминия и высокая сопротивляемость пайке из-за пленки окислов на поверхности. Большую роль играет наличие сильного электрохимического потенциала при контакте с таким металлом, как медь. В результате, в месте механического контакта меди и алюминия образуется прочная пленка окисла, имеющего высокое электрическое сопротивление. Это явление приводит к нагреву места соединения вплоть до расплавления проводников. Существуют жесткие ограничения и рекомендации по применению алюминия в электротехнике. Высокая пластичность позволяет изготавливать тонкую фольгу, которая используется в производстве конденсаторов высокой емкости. Легкость алюминия и его сплавов стали основополагающими при использовании в авиакосмической отрасли при изготовлении большинства элементов конструкции летательных аппаратов: от несущих конструкций, до элементов обшивки, корпусов приборов и оборудования.
Физические свойства алюминия зависят от его чистоты
Таблица физических свойств алюминия | |
| Температура плавления Тпл, °С | 660 |
| Температура кипения Ткип, °С | 2 327 |
| Скрытая теплота плавления, Дж/г | 393,6 |
| Теплопроводность l , Вт/м град (при 20° С) | 228 |
| Теплоемкость Ср, Дж/(г · град) (при 0–100°С) | 0,88 |
| Коэффициент линейного расширения α × 10-6, 1/°С (пр°С) | 24,3 |
| Удельное электросопротивление ρ × 10-8, Ом× м (при 20°С) | 2,7 |
| Предел прочности σ в, МПа | 40–60 |
| Относительное удлинение δ , % | 40–50 |
| Твердость по Бринеллю НВ | 25 |
| Модуль нормальной упругости E , ГПа | 70 |
Плотность алюминия
Плотность твердого и расплавленного алюминия снижается по мере увеличения его чистоты: Плотность алюминия при 20°С
| Степень чистоты, % | 99,25 | 99,40 | 99,75 | 99.97 | 99,996 | 99.9998 |
| Плотность при 20°С, г/см3 | 2,727 | 2,706 | 2,703 | 2,6996 | 2,6989 | 2,69808 |
Плотность расплавленного алюминия при 1000°С
| Степень чистоты, % | 99,25 | 99.40 | 99.75 |
| Плотность, г/см3 | 2,311 | 2,291 | 2,289 |
Температура плавления и кипения.
В момент плавления алюминия возрастает объем металла: для алюминия чистотой 99,65 % — на 6,25%, для более чистого металла — на 6,60 %. По мере повышения степени чистоты алюминия температура его плавления возрастает: Зависимисть температуры плавления алюминия от чистоты
| Степень чистоты, % | 99,2 | 99,5 | 99,6 | 99,97 | 99,996 |
| Температура плавления, °С | 657 | 658 | 659,7 | 659,8 | 660,24 |
Теплопроводность алюминия
Теплопроводность алюминия повышается с увеличением степени его чистоты. Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Электропроводность алюминия
Алюминий отличается высокой электропроводностью (четвертое место среди металлов — после серебра, меди и золота). Удельная электропроводность алюминия чистотой 99,99 % при 20°С равна 37,9 мкСм×м, что составляет 63,7% от электропроводности меди . Более чистый алюминий обладает электропроводностью, равной 65,9% от электропроводности меди. На электропроводность алюминия влияет ряд факторов: степень деформации, режим термической обработки и т. д., решающую же роль играет природа примесей, присутствующих в алюминии. Примеси по их отрицательному влиянию на электропроводность алюминия можно расположить в следующий ряд: Cr, V, Mn, Ti, Mg, Ag, Сu, Zn, Si, Fe Ni. Наиболее отрицательное влияние на электросопротивление алюминия оказывают примеси Сг, V, Мп и Ti . Поэтому в алюминии для электротехнической промышленности сумма Cr+V+Mn+Ti не должна превышать 0,015% (марка А5Е) и даже 0,01 % (А7Е) при содержании кремния соответственно 0,12 и 0,16 %.
Влияние примесей на электропроводность алюминия
Основными примесями в алюминии являются кремний, железо, медь, цинк и титан. При малых содержаниях кремния в алюминии (0,06%) величина Fe : Si (в пределах от 0,8 до 3,8) сравнительно мало влияет на его электросопротивление. При увеличении содержания кремния до 0,15—0,16% влияние Fe : Si возрастает. Ниже приведено влияние Fe : Si на электропроводность алюминия: Влияние Fe : Si на электропроводность алюминия
| Fe : Si | 1,07 | 1,44 | 2,00 | 2,68 | 3,56 |
| Удельное электросопротивление алюминия, ×10-2 мкОм·мм: | |||||
| нагартованного | 2,812 | 2,816 | 2,822 | 2,829 | 2,838 |
| отожженного | 2,769 | 2,771 | 2,778 | 2,783 | 2,788 |
Удельное электрическое сопротивление отожженной алюминиевой проволоки (ρ, мкОм·м) при 20°С в зависимости от содержания примесей можно приблизительно определить по следующей формуле: ρ=0,0264+0,007×(% Si)+0,0007×(% Fe) + 0,04×.
Отражательная способность
С повышением степени чистоты алюминия возрастает его способность отражать свет от поверхности. Так, степень отражения белого света от прокатанных алюминиевых листов (фольги) в зависимости от чистоты металла, возрастает следующим образом: для Аl 99,2%—75%, Аl 99,5%—84% и для Аl 99,8%—86%. Поверхность листа, изготовленного из электролитически рафинированного алюминия чистотой 99,996%, отражает 90% падающего на него белого света.
www.metmk.com.ua
Производство и рынок
Достоверных сведений о получении алюминия до XIX века нет. Встречающееся иногда со ссылкой на «Естественную историю» Плиния утверждение, что алюминий был известен при императоре Тиберии, основано на неверном толковании источника.
В 1825 году датский физик Ганс Христиан Эрстед получил несколько миллиграммов металлического алюминия, а в 1827 году Фридрих Вёлер смог выделить крупинки алюминия, которые, однако, на воздухе немедленно покрывались тончайшей плёнкой оксида алюминия.
До конца XIX века алюминий в промышленных масштабах не производился.
Только в 1854 году Анри Сент-Клер Девиль (его исследования финансировал Наполеон III, рассчитывая, что алюминий пригодится его армии) изобрёл первый способ промышленного производства алюминия, основанный на вытеснении алюминия металлическим натрием из двойного хлорида натрия и алюминия NaCl·AlCl3. В 1855 году был получен первый слиток металла массой 6—8 кг. За 36 лет применения, с 1855 по 1890 год, способом Сент-Клер Девиля было получено 200 тонн металлического алюминия. В 1856 году он же получил алюминий электролизом расплава хлорида натрия-алюминия.
В 1885 году был построен завод по производству алюминия в немецком городе Гмелингеме, работающий по технологии, предложенной Николаем Бекетовым. Технология Бекетова мало чем отличалась от способа Девиля, но была проще и заключалась во взаимодействии между криолитом (Na3AlF6) и магнием. За пять лет на этом заводе было получено около 58 т алюминия — более четверти всего мирового производства металла химическим путём в период с 1854 по 1890 год.
Метод, изобретённый почти одновременно Чарльзом Холлом в США и Полем Эру во Франции (1886 год) и основанный на получении алюминия электролизом глинозёма, растворённого в расплавленном криолите, положил начало современному способу производства алюминия. С тех пор, в связи с улучшением электротехники, производство алюминия совершенствовалось. Заметный вклад в развитие производства глинозёма внесли русские учёные К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др.
Первый алюминиевый завод в России был построен в 1932 году в городе Волхов. Металлургическая промышленность СССР в 1939 году производила 47,7 тыс. тонн алюминия, ещё 2,2 тыс. тонн импортировалось.
Вторая мировая война значительно стимулировала производство алюминия. Так, в 1939 году общемировое его производство, без учёта СССР, составляло 620 тыс. т, но уже к 1943 году выросло до 1,9 млн т.
К 1956 году в мире производилось 3,4 млн т первичного алюминия, в 1965 году — 5,4 млн т, в 1980 году — 16,1 млн т, в 1990 году — 18 млн т.
В 2007 году в мире было произведено 38 млн т первичного алюминия, а в 2008 — 39,7 млн т. Лидерами производства являлись:
- Китай (в 2007 году произвёл 12,60 млн т, а в 2008 — 13,50 млн т)
- Россия (3,96/4,20)
- Канада (3,09/3,10)
- США (2,55/2,64)
- Австралия (1,96/1,96)
- Бразилия (1,66/1,66)
- Индия (1,22/1,30)
- Норвегия (1,30/1,10)
- ОАЭ (0,89/0,92)
- Бахрейн (0,87/0,87)
- ЮАР (0,90/0,85)
- Исландия (0,40/0,79)
- Германия (0,55/0,59)
- Венесуэла (0,61/0,55)
- Мозамбик (0,56/0,55)
- Таджикистан (0,42/0,42)
В 2016 году было произведено 59 млн тонн алюминия
В 2019 было произведено 63,69 млн тонн алюминия
На мировом рынке запас составляет 2,224 млн т., а среднесуточное производство — 128,6 тыс. т. (2013.7).
В России монополистом по производству алюминия является компания «Российский алюминий», на которую приходится около 13 % мирового рынка алюминия и 16 % глинозёма.
Мировые запасы бокситов практически безграничны, то есть несоизмеримы с динамикой спроса. Существующие мощности могут производить до 44,3 млн т первичного алюминия в год. Следует также учитывать, что в будущем некоторые из применений алюминия могут быть переориентированы на использование, например, композитных материалов.
Цены на алюминий (на торгах международных сырьевых бирж) с 2007 по 2015 годы составляли в среднем 1253—3291 долларов США за тонну.
На конец 2019 года цена составляла 1951 долларов США/тонна. Мировой спрос на алюминий в 2019 составила 67,5 млн тонн, общая стоимость — 131 млрд долларов США.
Уменьшение температуры
Перед тем как приступать к плавке металла, можно выполнить определенные операции, которые позволят снизить температуру плавления. Например, иногда расплаву подвергают алюминиевый порошок. В порошкообразном состоянии металл начинает плавиться несколько быстрее. Но при такой обработке возникает реальная опасность того, что при взаимодействии с кислородом, который содержится в атмосфере алюминиевый порошок, начнет окисляться с большим выделением тепла и образования оксидов металла, этот процесс происходит при температуре 2300 градусов. Главное, в этот момент плавления не допустить контакта расплава и воды. Это приведет к взрыву.
https://youtube.com/watch?v=cIlonSuReH0





































