Добыча и происхождение ниобия
Тантал и ниобий часто встречаются вместе, на протяжении многих лет их практически не отличали друг от друга. По предложению Королевского химического общества он стал называться в честь греческой богини слез Ниобе, дочери короля Тантала.
Nb имеет запутанную историю. Джон Уинтроп открыл руду в штате Массачусетс в 1734 году и отправил ее в Англию. Минерал хранился в коллекции Британского музея в течение многих лет, пока в 1801 году его не стал изучать Чарльз Хэтчетт. Он обнаружил новый элемент в руде и назвал его колумбием в честь Колумбии, самого поэтического звучания Америки. В 1809 году английский химик Уильям Хайд Волластон сравнил колумбит с другим минералом, танталитом. Эти металлические элементы очень похожи, всегда находятся вместе и их трудно выделить.
В 1844 году Генрих Роуз, работая с образцами колумбита и танталита, создал две новые отдельные, но очень похожие кислоты, которые он назвал соответственно ниобиевой и пелоповой и переименовал элемент в ниобий. Двадцать лет спустя швейцарский химик Жан Шарль Галиссар де Мариньяк выделил металлический Nb путем нагревания хлорида в атмосфере водорода.

Как выглядит ниобий
В Соединенных Штатах в течение примерно 100 лет изначальный элемент назывался колумбий (символ Cb), тогда как в Европе его называли ниобием. В 1949 году Международный союз теоретической и прикладной химии официально принял ниобий в качестве официального названия элемента. Однако многие металлургические общества США до сих пор называют его колумбием.
Свойства и особенности производства
Образец чистого металла был изготовлен в 1864 году Кристианом Бломстрандом, который восстановил хлорид ниобия, нагревая его газообразным водородом. Почти весь Nb добывается в Бразилии и Канаде. Предполагается, что промышленное его количество в земной коре сохранится в течение следующих пяти веков. Согласно исследованиям, некоторые соединения ниобиевой пыли могут вызывать раздражение глаз и кожи, тем не менее, не зафиксированы какие-либо серьезные последствия при работе с Nb, так же как и негативного влияния его на экологию.
Элемент встречается в виде оксида и обладает сильной геохимической связью с танталом. Основные минералы — пирохлор и колумбит , состоящий из ниобата, танталата, железа и марганца. Пирохлор встречается обычно в карбонатитах и пегматитах, полученных из щелочных пород, связанных с минералами циркония, титана, тория, урана и редкоземельных элементов. Колумбит содержится в интрузивных пегматитах и биотитах, а также в щелочных гранитах. Однако, поскольку большинство таких месторождений невелики и распределены неравномерно на земле, они получаются, как побочный продукт других металлов.
Металл добывают открытым способом, руда, делится на блоки и перерабатывается путем разрыва, с помощью бульдозера, погрузки и транспортировки. Добыча в Квебеке (Канада) идет подземными методами. Концентрация руды достигается путем дробления и измельчения, магнитного разделения для удаления магнетита, а затем обесшламливания и флотационного разделения.
Концентрат пирохлора обычно восстановлен до феррониобия через алюминотермический процесс. Он смешивается с гематитом, алюминиевым порошком и небольшим количеством флюорошпатового и известкового флюсов в роторном смесителе. Затем выгружается в стальные контейнеры, облицованные огнеупорным кирпичом из магнезита.
Здесь смесь помещается в круглые углубления, сделанные из смеси извести, плавикового шпата и кварцевого песка, и восстанавливается воспламенением смеси алюминиевого порошка и хлората натрия или пероксида бария. Экзотермическая реакция длится примерно от 15 до 30 минут, а температура процесса порядка 2400 C. Большая часть примесей из концентрата, включая все оксиды тория и урана, попадают в расплавленный шлак, Когда реакция заканчивается, он отводится, и сосуд поднимается, оставляя металл остывать в песке.
Сплав товарного феррониобия измельчают до размеров частиц с составом:
- Nb – 62–69%;
- железа – 29–30%;
- кремния – 2%;
- алюминия – 1–3%.
Свойства ниобия (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Ниобий |
| 102 | Прежнее название | Колумбий |
| 103 | Латинское название | Niobium |
| 104 | Английское название | Niobium |
| 105 | Символ | Nb |
| 106 | Атомный номер (номер в таблице) | 41 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный металл |
| 109 | Открыт | Чарльз Хэтчет, Великобритания, 1801 г. |
| 110 | Год открытия | 1801 г. |
| 111 | Внешний вид и пр. | Блестящий металл серебристо-серого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0017 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-10 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 2,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000019 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 92,90638(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d4 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N12 O1 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 164 пм |
| 205 | Эмпирический радиус атома* | 145 пм |
| 206 | Ковалентный радиус* | 137 пм |
| 207 | Радиус иона (кристаллический) | Nb3+ 86 (6) пм, Nb4+ 82 (6) пм, Nb5+ 78 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 41 электрон, 41 протон, 52 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 5-ая группа (по старой классификации – побочная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -1, +1, +2, +3, +4, +5 |
| 302 | Валентность | I, II, III, IV, V |
| 303 | Электроотрицательность | 1,6 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 652,13 кДж/моль (6,75885(4) эВ) |
| 305 | Электродный потенциал | Nb3+ + 3e– → Nb, Eo = -1,1 В |
| 306 | Энергия сродства атома к электрону | 86,1 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 8,57 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | 2477 °C (2750 K, 4491 °F) |
| 403 | Температура кипения* | 4742 °С (5015 K, 8567 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 30 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 689,9 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,265 Дж/г·K (при 25 °C), 0,322 Дж/г·K (при 1000 °C) |
| 410 | Молярная теплоёмкость* | 24,44 Дж/(K·моль) |
| 411 | Молярный объём | 10,8 см³/моль |
| 412 | Теплопроводность | 53,7 Вт/(м·К) (при стандартных условиях), 53,7 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная |
| 513 | Параметры решётки | 3,301 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 275 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-03-1 |
Примечание:
205* Эмпирический радиус атома ниобия согласно и составляет 146 пм.
206* Ковалентный радиус ниобия согласно и составляет 164±6 пм и 164 пм соответственно.
402* Температура плавления ниобия согласно и составляет 2468 °С (2741 K, 4474 °F) и 2470 °С (2743,15 K, 4478 °F) соответственно.
403* Температура кипения ниобия согласно и составляет 4742 °С (5015 K, 8567 °F) и 4760 °С (5033,15 K, 8600 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) ниобия согласно и составляет 26,8 кДж/моль и 28 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) ниобия согласно и составляет 680 кДж/моль и 662 кДж/моль соответственно.
410* Молярная теплоёмкость ниобия согласно составляет 24,44 Дж/(K·моль).
Производство
Производители ниобия в 2006-2015 гг.
После отделения от других минералов получают смешанные оксиды тантала Ta 2 O 5 и ниобия Nb 2 O 5 . Первым этапом обработки является реакция оксидов с плавиковой кислотой :
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7 ] + 5 H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [NbOF 5 ] + 3 H 2 O
Первое разделение в промышленном масштабе, разработанное де Мариньяком , использует различные растворимости комплексных фторидов ниобия и тантала , моногидрата оксипентафторониобата калия (K 2 [NbOF 5 ] · H 2 O) и гептафтортанталата калия (K 2 [TaF 7 ]) в воды. В более новых процессах используется жидкостная экстракция фторидов из водного раствора органическими растворителями, такими как циклогексанон . Комплексные фториды ниобия и тантала экстрагируют отдельно из органического растворителя водой и либо осаждают добавлением фторида калия с получением комплекса фторида калия, либо осаждают аммиаком в качестве пентоксида:
- H 2 [NbOF 5 ] + 2 KF → K 2 [NbOF 5 ] ↓ + 2 HF
С последующим:
- 2 H 2 [NbOF 5 ] + 10 NH 4 OH → Nb 2 O 5 ↓ + 10 NH 4 F + 7 H 2 O
Для восстановления до металлического ниобия используется несколько методов . Электролизе расплавленной смеси K 2 [NbOF 5 ] и хлорида натрия является одним; другой – восстановление фторида натрием . С помощью этого метода можно получить ниобий относительно высокой чистоты. При крупномасштабном производстве Nb 2 O 5 восстанавливают водородом или углеродом. В алюмотермической реакции смесь оксида железа и оксида ниобия реагирует с алюминием :
- 3 Nb 2 O 5 + Fe 2 O 3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2 O 3
Для усиления реакции добавляют небольшие количества окислителей, таких как нитрат натрия . В результате получается оксид алюминия и феррониобий , сплав железа и ниобия, используемый в производстве стали. Феррониобий содержит от 60 до 70% ниобия. Без оксида железа для производства ниобия используется алюминотермический процесс. Для получения класса сверхпроводящих сплавов необходима дополнительная очистка . Электронно-лучевая плавка в вакууме – метод, используемый двумя основными распространителями ниобия.
По состоянию на 2013 год CBMM из Бразилии контролировал 85 процентов мирового производства ниобия. По оценкам Геологической службы США, производство увеличилось с 38 700 тонн в 2005 году до 44 500 тонн в 2006 году. Мировые ресурсы оцениваются в 4,4 миллиона тонн. За десятилетний период с 1995 по 2005 год производство увеличилось более чем вдвое, начиная с 17 800 тонн в 1995 году. В период с 2009 по 2011 год производство было стабильным на уровне 63 000 тонн в год с небольшим снижением в 2012 году до 50 000 тонн в год. .
| Страна | 2000 г. | 2001 г. | 2002 г. | 2003 г. | 2004 г. | 2005 г. | 2006 г. | 2007 г. | 2008 г. | 2009 г. | 2010 г. | 2011 г. | 2012 г. | 2013 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Австралия | 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? | ? | ? |
| Бразилия | 30 000 | 22 000 | 26 000 | 29 000 | 29 900 | 35 000 | 40 000 | 57 300 | 58 000 | 58 000 | 58 000 | 58 000 | 45 000 | 53 100 |
| Канада | 2290 | 3 200 | 3 410 | 3 280 | 3 400 | 3 310 | 4 167 | 3020 | 4380 | 4330 | 4 420 | 4 630 | 4,710 | 5 260 |
| Конго ДР | ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? | ? | ? |
| Мозамбик | ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? | ? | ? |
| Нигерия | 35 год | 30 | 30 | 190 | 170 | 40 | 35 год | ? | ? | ? | ? | ? | ? | ? |
| Руанда | 28 год | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? | ? | ? |
| Мир | 32 600 | 25 600 | 29 900 | 32 800 | 34 000 | 38 700 | 44 500 | 60 400 | 62 900 | 62 900 | 62 900 | 63 000 | 50 100 | 59 400 |
Меньшие количества находятся на месторождении Каньяка в Малави ( рудник Каньяка ).
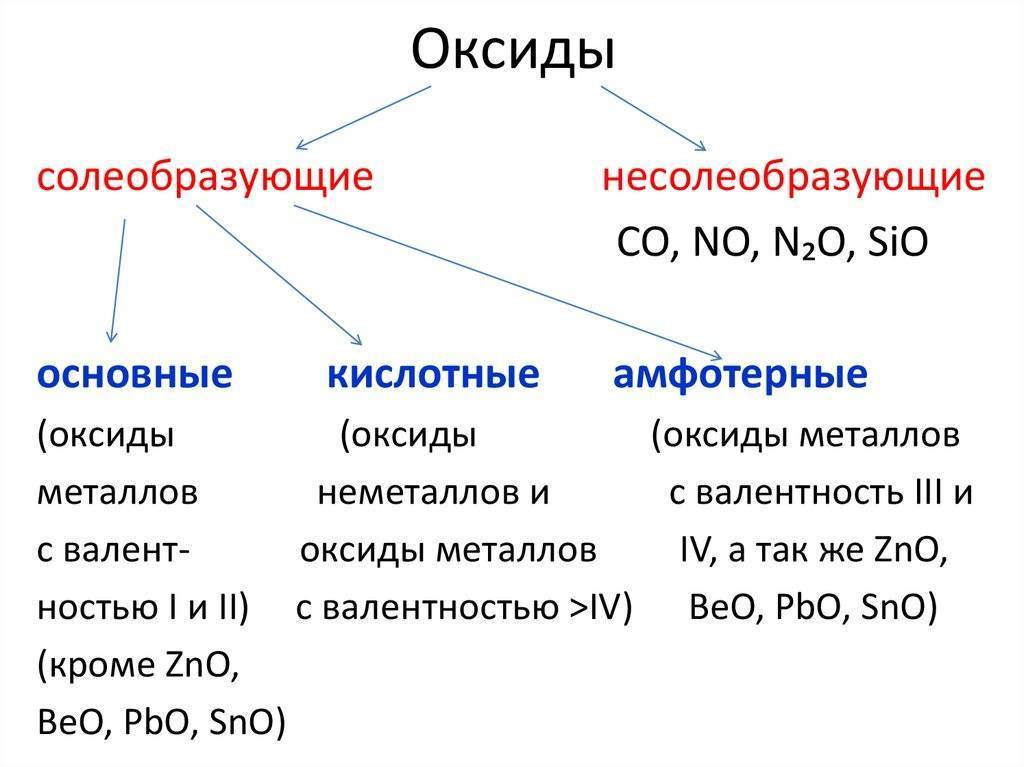
Химические соединения металлов
Среди таковых следует назвать несколько основных классов веществ, которые являются продуктами взаимодействия металлов с другими элементами и веществами.
- Оксиды, гидриды, нитриды, силициды, фосфиды, озониды, карбиды, сульфиды и прочие – бинарные соединения с неметаллами, чаще всего относятся к классу солей (кроме оксидов).
- Гидроксиды – общая формула Ме+х(ОН)х.
- Соли. Соединения металлов с кислотными остатками. Могут быть разными:
- средние;
- кислые;
- двойные;
- основные;
- комплексные.
4. Соединения металлов с органическими веществами – металлорганические структуры.
5. Соединения металлов друг с другом – сплавы, которые получаются разными способами.
Примечания[ | ]
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 249. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8.
- Materials Handbook: A Concise Desktop Reference, François Cardarelli, 2000, с.157.
- Венецкий С.И. Сорок первый // Рассказы о металлах. — Москва: Металлургия, 1979. — 240 с. — 60 000 экз.
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- Редкий ниобий на редкоземельном рынке
- Месторождение ниобия и тантала
- Larry D. Cunningham. USGS Minerals Information: Niobium (Columbium) and Tantalum(неопр.) . Minerals.usgs.gov (5 апреля 2012). Дата обращения: 17 августа 2012. Архивировано 25 ноября 2012 года.
- Запуск коллайдера//«Наука и технологии России» (неопр.) (недоступная ссылка). Дата обращения: 7 февраля 2009. Архивировано 21 сентября 2008 года.
- Ниобиевые монеты: очарование цвета (неопр.) (недоступная ссылка). Euro-Coins.News. Дата обращения: 12 марта 2012. Архивировано 28 мая 2012 года.
- Каталог коллекционных монет Австрии из драгоценных металлов (неопр.) (недоступная ссылка). Мир монет. Дата обращения: 19 марта 2012. Архивировано 15 февраля 2012 года.
- Для этого используется также титан в тех же количествах.
- Coin of time (неопр.) (недоступная ссылка). Дата обращения: 5 декабря 2007. Архивировано 12 марта 2008 года.
- Coin of time2 (неопр.) (недоступная ссылка). Дата обращения: 5 декабря 2007. Архивировано 22 мая 2009 года.
История открытия
Знакомство людей с металлом состоялось на заре 19 века благодаря европейским химикам:
- Первооткрывателем стал англичанин Чарльз Хэтчет. В 1801 году он исследовал экспонат Британского музея, присланный 70 лет назад из Америки.
- Спустя год его шведский коллега Андрес Экеберг открыл тантал – «близнец» ниобия по физическим и химическим характеристикам.
- Их считали одним элементом, пока немец Генрих Розе не доказал, что это разные вещества.
Позднее француз Анри Муассан («отец» рукотворных бриллиантов муассанитов) получил чистый металл, восстановив оксид ниобия в электропечи углеродом.

Еще интереснее история названия:
- Чарльз Хэтчет назвал минерал и выделенный металл «колумбитом» и «колумбием» (тогда США неофициально именовали Колумбией).
- Розе переименовал его в ниобий.
- Так ученый закрепил «родственность» элементов.
- Новое название не прижилось в англоязычном мире.
Ниобий и сверхпроводимость
Удивительное явление сверхпроводимости, когда при понижении температуры проводника в нем происходит скачкообразное исчезновение электрического сопротивления, впервые наблюдал голландский физик Г. Камерлинг-Оннес в 1911 г. Первым сверхпроводником оказалась ртуть, но не ей, а ниобию и некоторым интерметаллическим соединениям ниобия суждено было стать первыми технически важными сверхпроводящими материалами.
Практически важны две характеристики сверхпроводников: величина критической температуры, при которой происходит переход в состояние сверхпроводимости, и критического магнитного поля (еще Камерлинг-Оннес наблюдал утрату сверхпроводником сверхпроводимости при воздействии на него достаточно сильного магнитного поля).
Сейчас известно уже больше 2000 сверхпроводящих металлов, материалов и соединений, но подавляющее их большинство не пришло и видимо никогда не придет в технику либо из-за чрезвычайно низких величин критических параметров, о которых сказано выше, либо из-за неприемлемых технологических характеристик. Среди сверхпроводников, имеющих практическое значение, особенно популярны ниобий-титановые сплавы. Из них изготовлено большинство работающих в наши дни сверхпроводящих магнитов. Они пластичны, из них можно делать технические устройства и проводники сложных форм.
Как материал ленточных сверхпроводников ценен сплав ниобия с оловом Nb3Sn, станнид ниобия, открытый еще в 1954 г. Сверхпроводящий токонесущий элемент — шина со 150 000 жил — из станнида ниобия изготовлен в нашей стране. Подобные многожильные сверхпроводящие проводники намереваются использовать в новых термоядерных установках «Токомак-15».
Интерес для практики представляет еще одно интерметаллическое соединение ниобия — Nb3Ge. У тонкой пленки такого состава рекордно высокая критическая температура — 24,3 К. Правда, у литого Nb3Ge критическая температура — всего 6 К, да и технология приготовления сверхпроводящих элементов из этого материала достаточно сложна.
Довольно высокими значениями критической температуры обладают тройные сплавы: ниобий — германий — алюминий, а также некоторые интерметаллические соединения ванадия. И все же именно с ниобием и его соединениями связаны наибольшие надежды специалистов по сверхпроводникам.
Получение
Осн. видами ниобиевой продукции являются феррониобий (85–90%), пентаоксид Nb2O5, металлич. Nb и сплавы. Для произ-ва феррониобия (обычно содержит 65% Nb) обогащённые механич. методами концентраты пирохлора подвергают металлотермич. восстановлению в смеси с Fe2O3 и порошкообразным Al. Технич. пентаоксид получают выщелачиванием из концентратов и шлаков оловянной плавки действием фтороводородной кислоты с последующим отделением от Ta и очисткой методом жидкостной экстракции, осаждением гидроксида, сушкой и прокаливанием. Карбид NbC получают взаимодействием Nb2O5 с технич. углеродом в атмосфере Н2 при темп-ре 1800 °C и используют для изготовления керамич. нагревателей.
Получение чистого металлич. Н. ведут натриетермич. восстановлением K2NbF7, электролитич. восстановлением K2NbF7 и Nb2O5 во фторидном расплаве с последующей переплавкой в электродуговых и электроннолучевых печах. Порошкообразный Н. производят гидрированием металла, механич. измельчением и разложением в вакууме гидрида.
Объём мирового производства ок. 40 тыс. т/год.
В металлургической промышленности
Он очень полезен при производстве стали, в которой при высоких температурах он соединяется с углеродом и азотом с образованием очень мелких частиц карбида ниобия (NbC) и нитрида ниобия (NbN).
Следовательно, его присутствие в указанном материале помогает контролировать размер зерна и улучшать коррозионную стойкость.
Он также увеличивает механическую стойкость сплавов, особенно при низких температурах, что делает его полезным в авиационной промышленности, где он используется в ракетах и реактивных двигателях. В качестве дополнительного преимущества в этом применении среди тугоплавких металлов он имеет самую низкую плотность.

Его сплавы используются в балках строительных конструкций и нефтедобывающих платформ, а также в газо- и нефтепроводах. Некоторые сплавы ниобия с хромомолибденовой сталью используются в высокотемпературных устройствах, таких как чайники.
Он также применяется для изготовления износостойкой и стойкой к истиранию инструментальной стали. А благодаря своей высокой пластичности он может использоваться в процессах формования, среди которых можно отметить прессование, гибку и штамповку.

Применение ниобия
Применение ниобия становится все более распространенным, что объясняется большим количеством его преимуществ и важных характеристик. Основными отраслями, где используется ниобий, являются строительство различных видов транспортной техники, от космических ракет до компонентов других летательных аппаратов. Обширно его использование в электронике и радиотехнике.
При этом в различных отраслях используется в своих различных формах. К примеру, чистый ниобий используется для создания деталей летательных аппаратов, контейнеров и труб для жидких металлов.
Сплавы ниобия позволяют легировать цветные металлы, в том числе и уран. В результате они перестают подвергаться воздействию щелочных соединений.
Вычислительные устройства также подразумевают использования ниобия, поскольку он требуется для производства криотронов – сверхпроводящих элементов. К тому же, строительство большого адронного коллайдера было бы невозможно без использования соединений данного металла.
Высокая удельная емкость металла обусловила его применение при изготовлении электролитических конденсаторов. Стоит отметить, что использование тантала позволяет производить конденсаторы более высокого качества, однако в вопросах надежности конденсаторы из ниобия существенно лучше.
Наконец, ниобий используется при изготовлении памятных монет в некоторых странах мира. Конкретная формула сплава и определяет ценность этих монет.
Химические свойства V, Nb, Ta
Ванадий является более активным металлом, чем ниобий и тантал, но менее, чем титан. Из кислот-неокислителей, ванадий вступает в реакцию только с плавиковой кислотой:
2V+12HF = 2H3[VF6]+3H2↑
С горячим раствором концентрированной серной кислоты ванадий окисляется до соединений ванадила:
2V+12HF = 2H3[VF6]+3H2↑
Азотная кислота с плотностью выше 1,35 г/см3 окисляет и растворяет ванадий:
V+3H2SO4 = VOSO4+2SO2↑+3H2O
Полностью окисляют ванадий до высших степеней окисления хлорная, хлорноватая, бромноватая, йодноватая и пероксодисерная кислоты: HClO4, HClO3, HBrO3, HIO3, H2S2O8. Лучше всего ванадий растворяют царская водка и смесь азотной и плавиковой кислоты. При н.у. ванадий практически не окисляется на воздухе, не реагирует с растворами органических кислот и щелочей.
Реакционная активность ванадия повышается по мере роста температуры – порошок ванадия при нагревании на воздухе воспламеняется. С азотом при температуре 1000°C ванадий образует нитрид VN, с водородом – гидрид VH (500-900°C). Легче всего ванадий реагирует с галогенами, образуя при нагревании фториды (VF5), тетрахлориды (VCl4), трибромиды (VBr3), дииодиды (VI2).
Ниобий, и в большей степени тантал, еще менее склонны вступать в реакции с другими веществами, что объясняется наличием прочной защитной оксидной пленки на их поверхности. При н.у. ниобий медленно реагирует только со смесью азотной и плавиковой кислот, а тантал вообще с кислотами не реагирует. Даже при нагревании до температуры красного каления на воздухе слитки ниобия и тантала только тускнеют с поверхности. Измельченные в порошок ниобий и тантал при нагревании до 900°C сгорают в кислороде, мелкоизмельченный ниобий воспламеняется в расплавленной селитре. С галогенами ниобий и тантал взаимодействуют при нагревании до высоких температур. Также при значительном нагревании тантал и ниобий реагируют с серой, углеродом, аммиаком, азотом, сероводородом, водородом (реакция обратима).
Химические свойства
Химически ниобий довольно устойчив, но уступает в этом отношении танталу. На него практически не действуют соляная, ортофосфорная, разбавленная серная, азотная кислоты. Металл растворяется в плавиковой кислоте HF, смеси HF и HNO3, концентрированных растворах едких щелочей, а также в концентрированной серной кислоте при нагревании свыше 150 °C. При прокаливании на воздухе окисляется до Nb2О5. Для этого оксида описано около 10 кристаллических модификаций. При обычном давлении стабильна β-форма Nb2O5.
- При сплавлении Nb2O5 с различными оксидами получают ниобаты: Ti2Nb10O29, FeNb49O124. Ниобаты могут рассматриваться как соли гипотетических ниобиевых кислот. Они делятся на метаниобаты MNbO3, ортониобаты M3NbO4, пирониобаты M4Nb2O7 или полиниобаты M2O·nNb2O5 (M — однозарядный катион, n = 2-12). Известны ниобаты двух- и трехзарядных катионов.
- Ниобаты реагируют с HF, расплавами гидрофторидов щелочных металлов (KHF2) и аммония. Некоторые ниобаты с высоким отношением M2O/Nb2O5 гидролизуются:
- 6Na3NbO4 + 5H2O = Na8Nb6O19 + 10NaOH.
- Ниобий образует NbO2, NbO, ряд оксидов, промежуточных между NbO2,42 и NbO2,50 и близких по структуре к β-форме Nb2О5.
- С галогенами ниобий образует пентагалогениды NbHal5, тетрагалогениды NbHal4 и фазы NbHal2,67 — NbHal3+x, в которых имеются группировки Nb3 или Nb2. Пентагалогениды ниобия легко гидролизуются водой.
- В присутствии паров воды и кислорода NbCl5 и NbBr5 образуют оксигалогениды NbOCl3 и NbOBr3 — рыхлые ватообразные вещества.
- При взаимодействии ниобия и графита образуются карбиды Nb2C и NbC, твёрдые жаропрочные соединения. В системе Nb — N существуют несколько фаз переменного состава и нитриды Nb2N и NbN. Сходным образом ведёт себя ниобий в системах с фосфором и мышьяком. При взаимодействии ниобия с серой получены сульфиды: NbS, NbS2 и NbS3. Синтезированы двойные фториды Nb и калия (натрия) — K2[NbF7].
- Из водных растворов выделить электрохимически ниобий пока не удалось. Возможно электрохимическое получение сплавов, содержащих ниобий. Электролизом безводных солевых расплавов может быть выделен металлический ниобий.