Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений. При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой. В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3,эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.
Неметаллические покрытия
Неметаллические защитные покрытия применяются для изоляции металлических изделий от воздействия внешней среды (в первую очередь, влаги) и придания им эстетичного внешнего вида.
К неметаллическим относятся полимерные, резиновые, лакокрасочные, эмалевые, оксидные и др. покрытия.
Полимерные покрытия
На сегодняшний день данный вид покрытия металла является наиболее популярной альтернативой оцинковке и окраске изделий.
Детали, обработанные полимерными веществами, имеют долгий срок службы, эстетичный внешний вид, отличные электроизоляционные, высокотемпературные и противоизносные свойства.
В качестве напыляемого материала чаще всего выступают полиэстер, пластизоль, полиуретаны, поливинилдефторид и некоторые другие.
По структуре они похожи на краски, однако вместо пигмента содержат высокодисперсные частицы твердых смазочных веществ: дисульфида молибдена, графита, политетрафторэтилена (ПТФЭ) и пр. Эти компоненты равномерно распределены в полимерной связующем, в качестве которого могут выступать эпоксидные, акриловые, титанатовые и другие смолы.
Например, в России такие покрытия разрабатывает .
Основным предназначением АФП MODENGY являются:
- Средне- и тяжелонагруженные узлы трения скольжения (направляющие, зубчатые передачи, подшипники и т.д.)
- Детали ДВС (юбки поршней, подшипники скольжения, дроссельная заслонка и др.)
- Пластиковые и металлические компоненты автомобилей (замки, петли, пружины, скобы, механизмы регулировки в салоне автомобиля и т.д.)
- Резьбовые соединения и крепеж
- Трубопроводная арматура
- Другие пары трения металл-металл, металл-резина, полимер-полимер, металл-полимер.
Антифрикционные твердосмазочные покрытия (АТСП) MODENGY наносятся однократно на весь срок службы узлов трения, что позволяет полностью отказаться от регулярно восполняемых масел и пластичных смазок.
Высокая популярность АТСП обусловлена их высокой несущей способностью, низким коэффициентом трения, широким диапазоном рабочих температур, устойчивостью к воздействию воды и химикатов, работоспособностью в запыленной среде, условиях радиации и вакуума.
Тонкий слой защитного покрытия практически не влияет на исходную точность размеров детали.
Эмалирование
Эмаль – это тонкое покрытие на металле, обладающее антикоррозионными свойствами. Получают его с помощью высокотемпературной обработки стекловидного порошка, смешанного с водой.
Локальный обжиг детали производится в печи или при помощи горелки. В зависимости от вида и цвета покрытия температура обжига может колебаться от +700 °C до +900 °C. Необходимо помнить, что стекловидный слой эмали нельзя подвергать грубым механическим воздействиям, так как он достаточно хрупок и легко повреждается.
Оксидирование
Оксидирование – это окислительно-восстановительная реакция металла, которая возникает благодаря взаимодействию с кислородом, электролитом или специальными кислотно-щелочными составами. Результатом процесса является образование защитной пленки, которая увеличивает твердость поверхности, увеличивает срок службы деталей, улучшает приработку, снижает образование задиров.

Оксидирование бывает анодным, химическим, термическим, плазменным, лазерным (последнее доступно только в промышленных условиях).
Окрашивание
Данный метод антикоррозионной защиты металла хорошо известен каждому. Однако лакокрасочные покрытия не отличаются термостойкостью и износостойкость, повредить их очень легко.
Основным преимуществом окрашивания является низкая стоимость и достаточно простая технология. Достаточно провести тщательную подготовку поверхности и придерживаться рекомендаций по нанесению используемого материала.
Срок службы лакокрасочных покрытий зависит от условий эксплуатации деталей. При высоких нагрузок и температурах их не применяют, используя чаще всего в качестве декоративного слоя.
Возврат к списку
Способы защиты металлов от коррозии
Предотвращение начала или активного протекания коррозии – более удачный способ избавиться от проблем с разрушением металлов, чем постоянная замена или восстановление деталей. Поэтому все производители металлических изделий уделяют максимум внимания разработке и совершенствованию способов защиты своей продукции от ржавления.
На данный момент есть четыре основных направления:
- изменение свойств металла введением добавок. По этому принципу изготавливаются нержавеющие стали – добавки хрома (12%) повышают стойкость сплава к коррозии до почти полной невосприимчивости в нормальных бытовых условиях. Изменения температуры и состава окружающей среды снижают стойкость нержавеющей стали к коррозии;
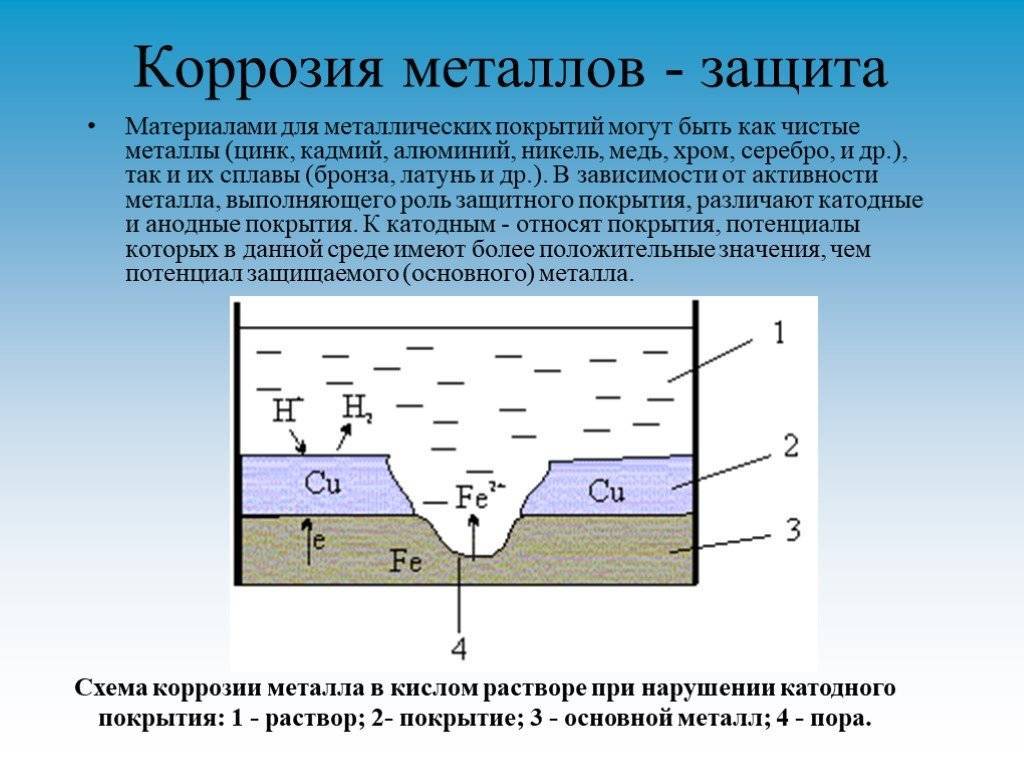
- использование защитных покрытий. Применяются различные (в чистом виде и комбинациях) лако-красочные, эмалевые, полимерные составы. Также – и с большим успехом – используется поверхностное нанесение менее активных химически металлов (оцинковывание, хромирование, никелирование, золочение);
- применение небольших элементов (пластинок, заклепок) из более активных металлов для сохранения основного объема и массы изделия – коррозии в этом случае подвергаются именно добавленные элементы. Отдельно можно выделить создание слабого тока в самом изделии для нейтрализации тока электрохимической коррозии. Применение этого способа ограничено определенными условиями эксплуатации;
- введение ингибиторов – веществ, угнетающих процесс коррозии – в окружающую изделие среду.
Последний метод требует отдельного рассмотрения.
Определение коррозии
Коррозия – это постепенное разрушение объектов, обычно металлов, вызванное активной окружающей средой-электролитом и химической реакцией окисления.
Суть коррозионного процесса – наличие постоянно действующей анодной реакции. Она вызывается за счёт растворения металла, который генерирует электроны. Часть энергии активации дополнительно расходуется на другой процесс, называемый катодной реакцией. Эти два процесса уравновешивают произведенные заряды. Зоны, вызывающие эти процессы, могут быть расположены близко или далеко друг от друга, в зависимости от ситуации.
Электроны, генерируемые в процессе, должны потребляться посредством катодной реакции. Ионы водорода и электроны вступают в реакцию с образованием атомарного, а затем и газообразного водорода. Однако водород является сильнейшим восстановителем, поэтому дальнейшую коррозию можно предотвратить, создав на поверхности металла тонкую газовую плёнку. Она служит поляризатором, уменьшающим контакт металла с водой и уменьшающим коррозию. Таким образом, всё, что разрушает барьерную плёнку, увеличивает скорость коррозии.
Основными факторами, определяющими интенсивность процесса, являются:
Скорость;
Температура;
Уровень возникающих механических и термических напряжений;
Характер протекающих химических реакций.
Коррозия сдерживает внедрение в производство новых металлических материалов и причиняет значительный ущерб экономике.
Дренажная защита
В большинстве случаев рельсы электрифицированных железных дорог и трамваев не имеют достаточной проводимости, в результате чего часть электрического тока стекает в почву.Такой ток называют блуждающим. Газопроводы, прокладываемые вблизи железных дорог, необходимо защищать от блуждающих токов,т к металлические газопроводы являются хорошими проводниками. В тех местах, где блуждающие токи из почвы входят в трубопровод, образуются катодные зоны, а в тех местах где токи выходят из трубопроводов в почву, образуются анодные зоны. В анодных зонах происходит активная коррозия металла трубы. Под воздействием блуждающих токов трубопроводы могут разрушаться насквозь в течение короткого периода, поэтому борьба с ними крайне необходима. Эффективным методом борьбы с коррозией, вызываемой блуждающими токами, является электрический дренаж,т е отвод блуждающих токов через проводник от газопровода к источнику возникновения этих токов.Отводом токов по проводнику понижается потенциал газопровода по отношению к почве,чем ликвидируются анодные и знакопеременные зоны и прекращается утечка токов с газопровода в землю. В зависимости от расположения тяговых подстанций и других факторов электродренажные линии от газопровода сооружаются либо непосредственно на тяговую подстанцию (на минусовую шину), либо на рельсы железной дороги. При сооружении электродренажной линии на минусовую шину тяговой подстанции электродренаж может быть прямым или поляризованным.Прямо дренаж применяется тогда, когда потенциал газопровода больше,чем потенциал системы, в которую отводятся блуждающие токи.При сооружении электродренажной линии на рельсы электродренаж должен быть обязательно поляризованным. Поляризованный дренаж отличается от прямого тем, что в схему дренажа вводятся поляризованные дренажные установки, устраняющие возможность обратного течения электрических токов на газопровод. Электродренажная линия может быть кабельной или воздушной. На электродренажной линии устанавливают контрольно-измерительные приборы.
Наибольшее распространение на газопроводах получили универсальные поляризованные дренажные установки типа УПДУ-57.
Обработка агрессивных жидкостей
Повреждение металлических конструкций происходит как снаружи, так и внутри. Даже жидкость с нейтральным уровнем кислотности (вода) может быстро разрушить трубопровод, если в ее составе содержатся бикарбонаты, карбонаты, кислород, которые являются причиной возникновения ржавчины. Обычная очистка внутренних поверхностей в таких сооружениях невозможна. Оптимальным выходом будет предварительное введение в жидкость соды, карбоната натрия или кальция. Такой обработкой воды можно снизить агрессивность транспортируемой жидкости.
Подземные емкости, изготовленные из цинковых сплавов, защищают путем введения в транспортируемую или хранящуюся среду силикатов, фосфатов или поликарбонатов. В результате химической реакции на цинковой поверхности появляется тонкая пленка, предупреждающая развитие ржавчины.

Другие способы защиты
Кроме катодной защиты авто от коррозии, в народе популярны разные альтернативные методы. Не все они одинаково хороши, но помогают продлить срок службы машины на несколько лет.
Анодная методика
Применяются специально изготовленные особой формы детали из металлов с более высоким электродным потенциалом, чем у железа. В результате при возникновении гальванической пары растворяется именно эта деталь – расходный электрод. Металл же самого кузова практически не страдает. Этот способ – анодная защита авто от коррозии.
Анодная защита авто от коррозии
Чаще всего применяют накладки из цинка или сплавов магния. Многочисленные отзывы водителей, ставивших в колесные ниши куски цинка, подтверждают действенность этого способа защиты на 3-5 лет. Недостаток способа – необходимость следить за протекторными электродами, при необходимости обновляя их.
Оцинковка кузова
Покрытие металла кузова цинком – еще один распространенный прием защитить машину от ржавчины на весь период ее службы (часто на 15-20 лет). Этим путем пошли крупнейшие западные производители, выпуская премиальные марки своих автомобилей с заводской горячей оцинковкой кузовов.
Оцинковка кузова
Безусловным лидером в этом направлении является Audi, разработавшая много патентов на тему технологий защитного покрытия. Именно модель Audi 80 – первый серийный образец с такой обработкой, а начиная с 1986 года ее имеют все производимые под этим брендом машины. Другие участники концерна VW Group также используют горячую оцинковку: «Фольксваген», «Шкода», «Порше», «Сеат».
Кроме немецких, настоящую оцинковку кузовов получили некоторые японские модели: «Хонда Аккорд», «Пилот», «Легенд».
Грунтовки и лакокрасочные материалы
Применительно к теме электрохимической защиты, упоминания заслуживают протекторные составы лакокрасочных материалов, содержащие частички цинка. Это фосфатирующие и катафорезные грунты.
Нанесение лакокрасочных материалов
Принцип их действия тот же: создается контакт железа со слоем более активного металла, который и расходуется в гальванических реакциях в первую очередь.
Ламинирование
Метод защиты поверхности кузова от ржавчины и абразивного истирания путем оклейки специальной прочной прозрачной пленкой. Хорошо проведенная обработка практически не видима глазу, выдерживает значительные перепады температур и не боится вибрации.
Ламинирование авто
Как и другие способы декоративной защиты поверхности, способ сохраняет автомобилю товарный вид, но оставляет нерешенной проблему с коррозией в труднодоступных местах.
Жидкое стекло
Создается дополнительный упрочняющий слой покрытия поверх базового лакокрасочного, обладающий повышенной прочностью. Наносится на обезжиренный и промытый кузов машины, который предварительно нагревают горячим воздухом. Полимерная основа материала растекается и после затвердевания полируется. Таким способом удается уберечь заводской слой краски от проникновения сквозь него атмосферной влаги и этим на небольшое время сдержать коррозию.
Керамика жидкое стекло для авто
Полной защиты от ржавчины метод не дает. Защищает в основном внешний вид автомобиля от видимых проявлений, но оставляя без внимания скрытые очаги.
Работа с днищем
Чтобы уберечь днище и колесные арки от попадания электролитов (дорожная грязь, вода с солью), применяются покрытия различными мастиками на битумной, каучуковой и полимерной основе.
Работа с днищем авто
Используются локеры (подкрылки) из полиэтилена. Все эти виды обработки проигрывают по эффективности электрохимической защите кузова автомобиля, но позволяют на время отсрочить сквозную ржавчину.
https://youtube.com/watch?v=RSF5J_M8oYE%3F
2 Как работает стандартная катодная поляризация металлов?
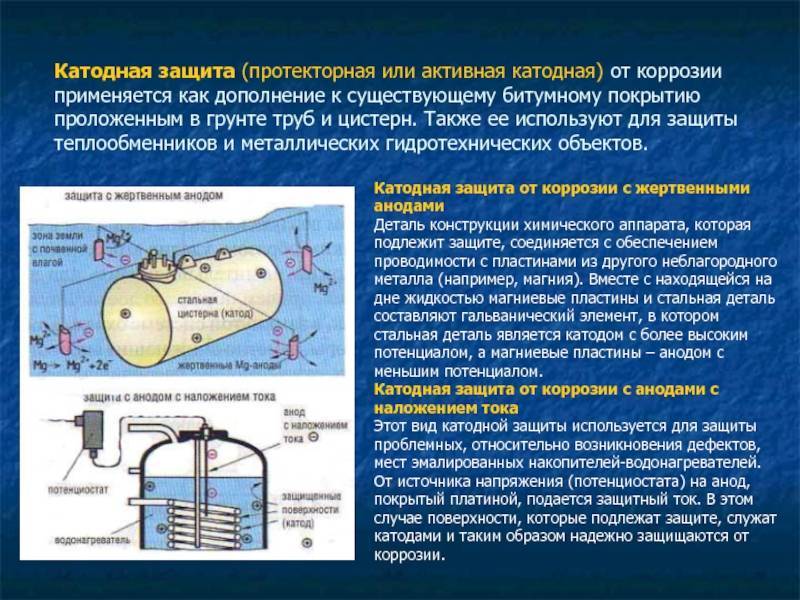
Катодная защита от коррозии производится посредством использования наложенного тока. Он поступает на конструкцию от выпрямителя либо иного источника (внешнего) тока, где промышленный по частоте переменный ток модифицируется в требуемый постоянный. Объект, который защищается, подключают к выпрямленному току (к «минусовому» полюсу). Конструкция, таким образом, является катодом. Анодное заземление (второй электрод) подключают к «плюсу».
Важно, чтобы между вторичным электродом и конструкцией имелся хороший электролитический и электронный контакт. Первый обеспечивается грунтом, куда погружают анод и объект защиты
Грунт в данном случае выполняет роль электролитической среды. А электронного контакта добиваются с помощью проводников из металлических материалов.
Регулирование катодной антикоррозионной защиты осуществляется посредством поддержания защитного потенциала между электролитической средой и индикатором потенциала поляризации (либо непосредственно конструкцией) на строго определенной величине. Замеряют показатель вольтметром с высокоомной шкалой.
Пример работы катодной защиты
Здесь необходимо понимать, что у потенциала есть не только поляризационный компонент, но и еще одна составляющая – падение (омическое) напряжения. Такое падение возникает из-за протекания через эффективное сопротивление катодного тока. Причем качество катодной защиты зависит исключительно от поляризации на поверхности изделия, которое предохраняется от ржавления. По этой причине выделяют две характеристики защищенности металлоконструкции – наибольший и наименьший потенциалы поляризации.
Эффективное регулирование поляризации металлов, учитывая все сказанное, становится возможным в том случае, когда показатель омического компонента исключается из величины полученной разности потенциалов. Добиться этого можно при помощи особой схемы замера потенциала поляризации. Описывать ее в рамках данной статьи мы не будем, так как она изобилует множеством специализированных терминов и понятий.
Для защиты неизолированных трубопроводов и других конструкций необходимо использовать существенные токи, что экономически невыгодно и технически сложно.
Барьерные методы
Традиционная защита машины от коррозии. Грунт предохраняет металл от попадания на него влаги, одновременно является связующим звеном между кузовом и краской. Лакокрасочные материалы повышают степень сохранности, но оба средства не предотвращают появления ржавчины.
Процесс покраски автомобиля на заводе обеспечивает максимально возможную степень защиты кузова на первоначальном этапе. Помимо обезжиривания, промывки, оцинковки корпус машины подвергается фосфатированию. Фосфатирование кузова автомобиля подразумевает погружение детали в ванную с растворенными солями фосфора. Процедура обеспечивает дополнительную антикоррозийную сохранность и беспроблемную грунтовку.
Современные лакокрасочные материалы предлагают максимальную защиту и постоянно совершенствуются. Защитное покрытие Raptor Upol выпускается специально для внедорожников. Средство ложится на поверхность авто полиуретановой пленкой, защищая от коррозии. Единственным недостатком считается матовый вид покрытия.
Ламинирование
Защита кузова автомобиля этим способом представляет собой обтягивание машины пленкой. Ламинат приклеивается к кузову и повышает сохранность любой его части. Перед проведением процедуры поверхность автомобиля проходит тщательную подготовку – моется, сушится, заделываются царапины, сколы, трещины, очаги коррозии. На правильно подготовленной детали пленка держится пару лет, причем она выдерживает максимально интенсивный режим использования автомобиля.
Причины повреждения металлических конструкций
Причин для коррозии металлических изделий достаточно:
- Химические реакции. Разрушение происходит при взаимодействии металла с различными химическими соединениями (кислотами, щелочами и пр.). Возникающая как продукт химической реакции ржавчина последовательно разъедает трубопровод.
- Электрохимические процессы. Этот вид коррозии один из самых агрессивных. Появляется, если труба или судно находится в электролите, где образовываются катоды и аноды. Возникающая ржа быстро распространяется, повреждая самый толстый металл.
- Атмосферные явления. При взаимодействии металла с водой, паром, воздухом выделяется оксид железа, который и разрушает сооружение.
Защита металла от коррозии
От коррозии необходимо защищать различные емкости, корпусы судов, резервуары, которые эксплуатируются в экстремальных условиях. Существует несколько вариантов формирования защиты:
- обработка химическими составами;
- покрытие стенок защитными материалами;
- предупреждение блуждающих токов;
- организация катода или анода.
Защита металла от ржавчины предполагает целый комплекс мер:
- Пассивные действия. Во время монтажа трубопровода до прилежащей почвы оставляют некоторый зазор. Он предупреждает попадание грунтовых вод с примесями на металлическую поверхность. Трубопровод покрывают специальными составами, которые защищают металл от негативного воздействия грунта. Затем наносят специальные химические вещества, образующие защитную пленку на металлической поверхности.
- Активная защита. Создается электродренажная система, защищающая трубопровод от блуждающих токов. Металлическую поверхность от разрушения защищают созданием анода или катода.

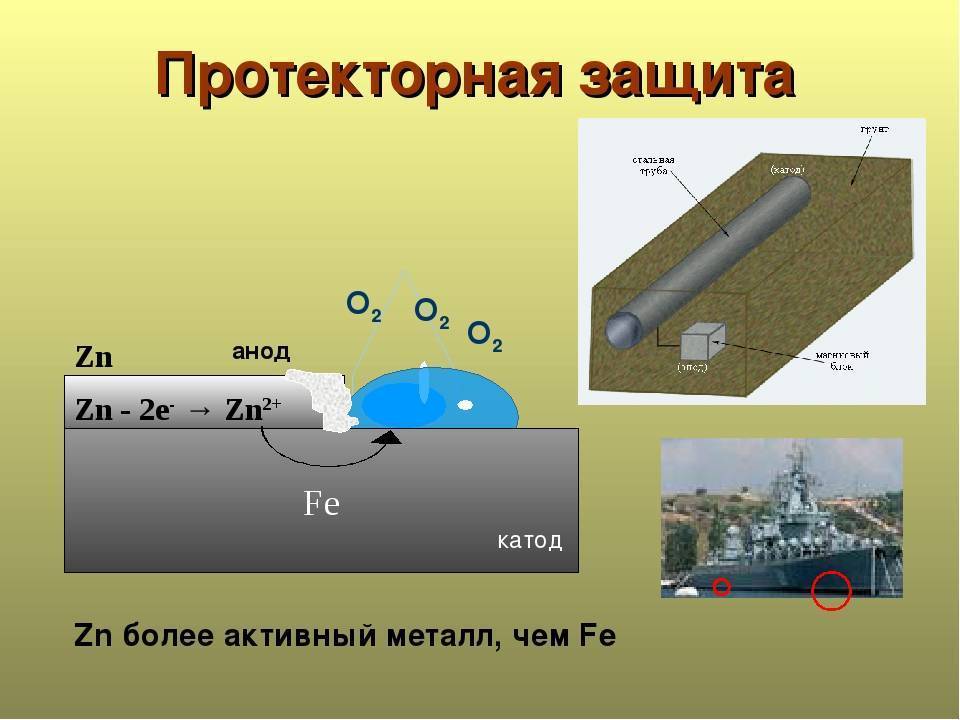
Что такое протекторная защита?
Протекторная защита — вариант антикоррозийной обработки, которая предполагает контакт металлической предохраняемой поверхности с протектором – ингибитором, более активным металлом. Под воздействием воздуха ингибитор предохраняет основное изделие (трубопровод, систему водоснабжения или отопления, корпус корабля и пр.) от разрушения.
Протекторная защита металлов от коррозии является оптимальной при отсутствии возможности проведения специальных электрических линий для создания эффективной катодной защиты перед электрохимической ржавчиной либо при нецелесообразности такого метода. Применять протекторную защиту целесообразно на малогабаритных объектах либо в случаях, когда поверхность обрабатываемого сооружения покрыта изоляционным материалом.
Протектор может полностью предохранить от повреждения основной объект в случае, если показатель переходного сопротивления между объектом и окружающей средой незначительный.
Но протекторная защита от коррозии имеет положительный эффект только на каком-то расстоянии, то есть каждый из видов протекторов имеет свой радиус антикоррозийного действия. Это максимальное расстояние протектора от предохраняемого объекта.
Для антикоррозийной защиты применяют установки, которые состоят из одного или нескольких протекторов, соединительных кабелей и контрольно-измерительных участков. Если есть необходимость, то в схему включают шунты, регулирующие резисторы, поляризованные элементы. Монтируют установки ниже уровня промерзания грунта (не менее 1 метра). Располагают протектор на расстоянии 3 — 7 метров от защищаемого сооружения. Более близкое может спровоцировать повреждение изоляционного слоя солями растворяющегося ингибитора.
Протекторная защита от коррозии трубопроводов предполагает, что электроны более активного металла будут присоединяться к ионам менее активного вещества. В результате такого взаимодействия происходят два процесса:
- Менее активный металл восстанавливается.
- Протектор окисляется, защищая основное сооружение от коррозии.
Так как во время активного взаимодействия с окружающей средой и трубопроводом протектор полностью «растворяется» или просто теряет контакт с предохраняемым сооружением, то защитный механизм периодически необходимо восстанавливать.

Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
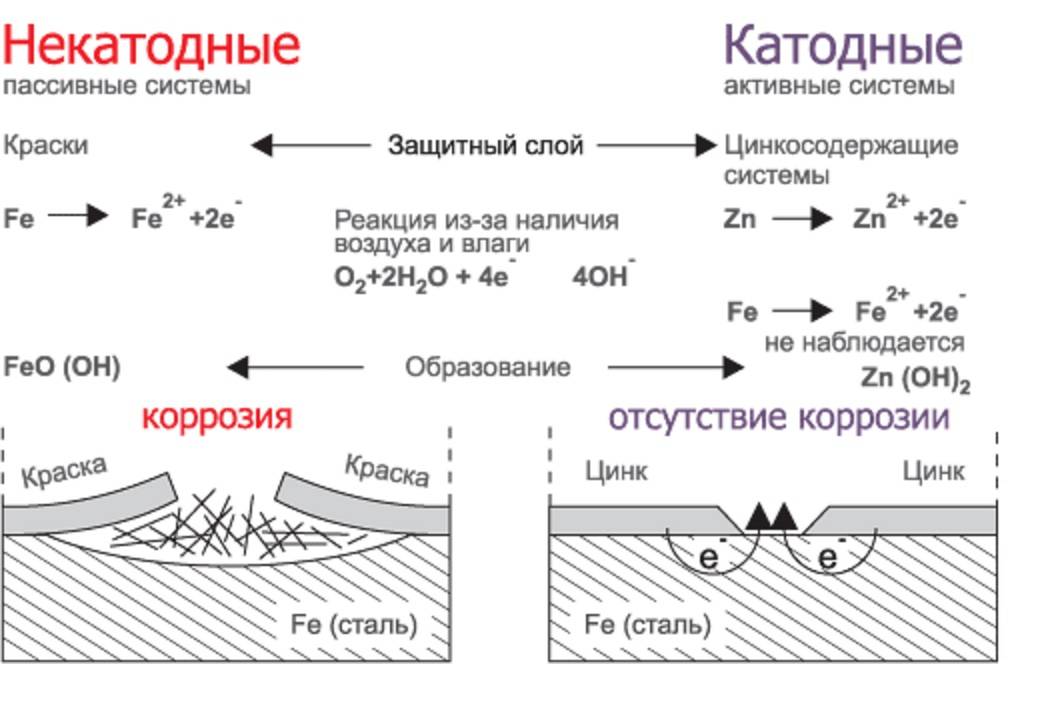
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

Грунт-преобразователь ржавчины
При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
диапазон потенциалов
Потенциал, который соответствует этим процессам, в зависимости от природы агрессивной среды, может изменяться от -0,83 до 0 В. Для нейтрального водного раствора при температурах, близких к стандартной, он равен примерно -0,41 В., Следовательно, ионы водорода, содержатся в воде и в нейтральных водных системах, могут окислять только металлы с потенциалом, меньшим, чем -0,41 в (расположены в ряду напряжений до кадмия). Учитывая то, что некоторые из элементов защищены оксидной пленкой, число металлов, склонных к окислению в нейтральных средах ионами водорода, незначительное.
В результате электрохимическая поляризация происходит на контактирует с водой металлической поверхности памяти. Это приводит к остановке коррозии — при условии правильной настройки. Частичные реакции показаны в обзоре «Движения ионов». Хранение становится катодом. Контактирует с водой поверхность хранения представляет собой катод, контактирует с магниевым анодом. Веществом, вызывающим коррозию, является молекулярный кислород, растворенный в воде. Он направляет свою атаку без защитной меры железом стены хранилища.
В этом случае образуются оксиды железа, то есть ржавчина. Движущей силой для коррозии является катодная частичная реакция восстановления кислорода. Если стенка для хранения приводится в контакт с металлом, который менее благородный, чем сталь, то атака кислорода на железный материал стенки контейнера опущена. Такими менее благородными материалами, например, магний, цинк или алюминий. Из них могут быть изготовлены гальванические защитные аноды. Носители заряда, необходимые для катодного восстановления кислорода, затем предоставляются защитным анодом, а не стенкой для хранения.
Если влага пленка содержит растворенный кислород воздуха, то он способен, в зависимости от характера среды, связывать электроны эффектом кислородной деполяризации. В этом случае схема электрохимической коррозии выглядит следующим образом:
- В 2 + 4е + 2Н 2 О = 4ОН — или
- В 2 + 4е + 4Н + = 2Н 2 О.
Потенциалы указанных электродных реакций при температурах, близких к стандартной, меняются от 0,4 В (щелочная среда) до 1,23 В (кислая среда). В нейтральных средах потенциал процесса восстановления кислорода при указанных условиях соответствует значению 0,8 В., Следовательно, растворенный кислород способен окислять металлы с потенциалом менее 0,8 В (расположены в ряду напряжений до серебра).
Таким образом, реакция коррозии перенаправляется на анод, который жертвует материалом во времени — и поэтому также упоминается как жертвенный анод. Он предназначен для легкого снятия и замены в таком случае. На защищенном объекте металлическая накопительная стенка возникает в результате электрохимических процессов для изменения условий электрического заряда. Потенциал электрохимической стенки уменьшается, так что скорость коррозии замедляется на порядок. Сдвиг электрохимического потенциала на более отрицательный, то есть более катодный, значение, в конечном счете ответственность за ингибирования коррозии, дает название процесса: катодная защита от коррозии.
4 Защита трубопроводов методом катодной поляризации
Разгерметизация различных по назначению трубопроводов происходит во многих случаях из-за их коррозионного разрушения, вызываемого появлением разрывов, трещин и каверн. Особенно подвержены ржавлению подземные коммуникации. На них образуются зоны с разным потенциалом (электродным), что обуславливается гетерогенностью грунта и неоднородным составом металлов, из которых изготавливаются трубы. За счет появления указанных зон начинается процесс активного формирования коррозионных гальванических компонентов.
Катодная поляризация трубопроводов, выполняемая по схемам, описанным в начале статьи (гальваника или внешний источник энергии), базируется на уменьшении скорости растворения материала труб в процессе их эксплуатации. Достигается подобное уменьшение посредством смещения коррозионного потенциала в зону, имеющую по отношению к естественному потенциалу более отрицательные показатели.
Защита трубопроводов от коррозии
Еще в первой трети 20 столетия был определен потенциал катодной поляризации металлов. Его показатель равняется –0,85 вольт. В большинстве грунтов естественный потенциал металлических конструкций находится в диапазоне от –0,55 до –0,6 вольт.
Это означает, что для эффективной защиты трубопроводов требуется «передвинуть» коррозионный потенциал в отрицательную сторону на 0,25-0,3 вольт. При такой его величине практическое влияние ржавления на состояние коммуникаций почти полностью нивелируется (коррозия за год имеет скорость не более 10 микрометров).
Методика с применением источника тока (внешнего) считается трудоемкой и достаточно сложной. Зато она обеспечивает высокий уровень защиты трубопроводов, ее энергетический ресурс ничем не ограничивается, при этом сопротивление (удельное) грунта оказывает минимальное влияние на качество защитных мероприятий.
Методика с применением источника тока
Источниками питания для катодной поляризации обычно являются воздушные электролинии на 0,4; 6 и 10 кВ. На местностях, где таковых нет, допускается использование газо-, термо и дизель-генераторов в качестве источников энергии.
Ток-«защитник» распределяется неравномерно по протяженности трубопроводов. Наибольшая его величина отмечается в так называемой точке дренажа – в месте, где производится подключение источника. Чем больше расстояние от этой точки, тем меньше защищены трубы. При этом и чрезмерный ток непосредственно в зоне подключения оказывает негативное влияние на трубопровод – высока вероятность водородного растрескивания металлов.
Метод с использованием гальванических анодов демонстрирует неплохую эффективность в грунтах с малым показателем омности (до 50 ом*м). В грунтах высокоомной группы его не применяют, так как особых результатов он не дает. Здесь стоит добавить, что аноды изготавливают из сплавов на основе, алюминия, магния и цинка.